Was darf Zahnersatz (auf eigenen Zähnen) kosten? Übersicht der Preise.
Was ist die beste Implantatoberfläche: glatt, mikro-rau oder beschichtet?
Die ersten Zahnimplantate in den 60er Jahren wurden aus einer Titanstange „gedreht“, ganz ähnlich wie alltägliche Metallschrauben. Die Oberfläche wurde nach diesem Herstellungsprozess nicht mehr weiter behandelt. Man fand heraus, dass der Knochen mit dieser relativ glatten „maschinierten“ Oberfläche eine Verbindung einging (Osseointegration), das war revolutionär. Allerdings liessen sich die Zahnimplantate mitunter aber noch nach Monaten wieder aus dem Knochen herausdrehen. Der Verbund war also nicht sicher bzw. optimal.
Titan-Plasmaspray: raue Oberfläche für mehr Halt
Einen besseren Halt sollte die Vergrößerung der Implantatoberfläche erzielen. Ein technisch erprobtes Verfahren hierfür war das Aufbringen von hoch erhitztem, flüssigem Titan auf die Schraubenoberfläche: Titan-Plasma-Spray (TPS) in den 80er Jahren. Beim Erkaltungsprozess entstehen dabei sehr unregelmäßige Zacken und Vertiefungen, die für das Einwachsen von Knochenzellen ein griffigeres Relief bilden.
Positive Erfahrungen mit dieser Oberfläche hat man zunächst mit Hüftprothesen machen können.
Leider hat die extrem aufgeraute, zerklüftete Topographie aber nicht nur Vorteile. So ist der Abrieb von Titanpartikeln beim Eindrehen der Implantate hoch, und die Titan-Plasma-Spray-Oberfläche zeigt sich sehr anfällig für hartnäckige Anlagerung von Bakterien. Die Folge können eine schlecht therapierbare Periimplantitis sein, die zum Implantatverlust führen kann. Daher gibt es heutzutage kaum noch Implantatsysteme mit TPS-Oberfläche.

Vergrößerung der Implantatoberfläche für eine sichere Knochenverbindung
Die ideale Implantatoberfläche
Seit Jahrzehnten arbeiten die Implantathersteller an der optimalen Oberfläche. Durch zahlreiche Untersuchungen konnten bestimmte Faktoren isoliert werden, die die Anlagerung von Knochen erleichtern und einen dauerhaften Verbund begünstigen. So sollte die Rauigkeit bei 1-2 µm liegen, um für einen schnellen ersten Schritt zu sorgen: die Anlagerung von Blutplättchen (Thrombozyten) an die Implantatoberfläche.
Gestrahlte Implantate
Die Aufrauung des Titans wird hier durch Abtrag erzielt, wobei sich durch die Wahl des Strahlmaterials, der Partikelgröße und des Drucks die Rauigkeit sehr gut steuern lässt, und man damit perfekt auf die „Wünsche“ der Knochenzellen eingehen kann. Als Strahlmittel werden Titanpartikel, Keramiken oder auch Korund eingesetzt.
Gestrahlte Oberflächen lassen sich durch zusätzliche Verfahren wie z.B. Säureätzung oder Beschichtung noch weiter optimieren.

Gestrahlte und geätzte Implantaoberfläche (Ankylos®, Fa. Dentsply Sirona)
Säureätzung
Auch die Behandlung des Titans mit Säure ist ein abtragendes Verfahren. Über die Art der Säure, die Konzentration und die Wirkdauer lassen sich sehr regelmäßige Muster in der gewünschten Rauigkeit erzielen. Die Säurebehandlung muss auf den Punkt erfolgen. Ein zu langes Verweilen kann die Struktur des Implantats schwächen. Ein Hersteller verwendet ein zusätzliches Vakuum um die Hydrophilie („Wasserliebigkeit“, verbesserte Kontaktaufnahme des Blutkoagulums) zu erhöhen.
Auch bei geätztem Titan besteht die Option, durch eine Weiterbehandlung mit Beschichtung die Oberflächeneigenschaften noch zu verbessern.
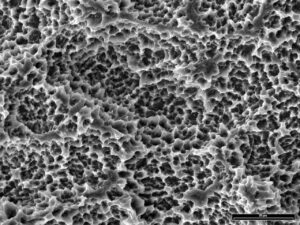
SLA®-Implantatoberfläche (Fa. Straumann)
Oberflächenvergrösserung durch anodische Oxidation
Bei der anodischen Oxidation handelt es sich um ein additives (auftragendes) Verfahren. Unter Einleitung von Strom in einer phosphathaltigen Elektrolytflüssigkeit wird durch Funkenentladung ein keramisches Biomaterial aufgetragen und so eine osteokonduktive (knochenleitende) raue Oberfläche erzeugt.
Auch die anodisch oxidierte Oberfläche kann durch weitere Beschichtungen ergänzt werden.
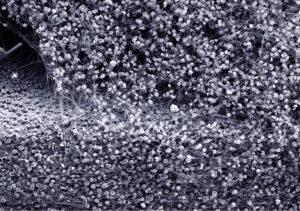
TiUnite® Oberfläche mit angelagerten Zellen (Fa. Nobel Biocare)
Beschichtung mit Hydroxylapatit und Calciumphosphat-Nanopartikeln
Hydroxylapatit (HA) ist dem Knochen verwandt und sorgt dafür, dass sich Knochenzellen besonders schnell anlagern. Die ersten Versuche der Beschichtung mit HA haben aber nicht dauerhaft funktioniert. Die recht dicke Beschichtung löste sich nach einiger Zeit vom Implantatkörper- womit auch der Halt des Implantats verloren ging.
Heutige Hydroxylapatit-Beschichtungen sind hauchdünn (Nanoschichtdicke) und sorgen nur für einen perfekten Erstkontakt. Danach lösen sie sich auf, und die Osteozyten (Knochenzellen) verbinden sich mit der Titanoxid-Oberfläche. Auch Calciumphosphat wird mit dem gleichen Ziel in einer Schichtdicke im Nanobereich aufgetragen und hat einen positiven Effekt auf die Anheftung von Knochenzellen.
Nitrit-Beschichtung von Implantatoberfächen
Ein weiterer Ansatz, die Implantatoberfläche zu optimieren, ist durch Nitrit-Beschichtung die Anheftung von Bakterien an den Implantathals zu verhindern. Zurzeit ist eine Zirkon-Nitrit-Beschichtung auf dem Markt, die einer Periimplantitis vorbeugen soll.
Rückstände sind ein Risiko
Nach allen Verfahren zur Oberflächenoptimierung muss eine 100%ige Reinigung erfolgen, damit keine chemischen Rückstände (Säure oder Reinigungsmittel) oder Fremdpartikel (Strahlmittel) auf der Implantatoberfläche zurückbleiben. Diese können zu entzündlichen, immunolgischen Reaktionen führen. Die absolute Reinheit der Oberfläche ist mit das wichtigste Qualitätskriterium eines Implantatsystems.
IMPLANTATE.COM-FAZIT
Die modernen Implantat-Topographien zeichnen sich allesamt durch eine rasche Knochenanlagerung und hervorragende Osseointegration aus. Die Unterschiede zwischen den verschiedenen Oberflächen sind bei der Einheilung eher akademisch zu sehen. Allerdings dürfte sich der langfristige Implantaterfolg durch Oberflächen mit günstigen Anti-Periimplantitis-Eigenschaften noch verbessern lassen.

Gibt es auch Zahnersatz-Alternativen die besser sind als Implantate?
Branemark ,Zarb u. Albrektsson, Gewebeintegrierter Zahnersatz: Osseointegration in klinischer Zahnheilkunde, Quintessenz Berlin 4., Auflage 1990
Asbjorn Jokstad, Osseointegration and Dental Implants, John Wiley & Sons 2009
Junker R, Dimakis A, Thoneick M, Jansen JA. Effects of implant surface coatings and composition on bone integration: a systematic review. Clin Oral Implants Res 2009;(Suppl 4):185–206.
Feldman S, Boitel N, Weng D, Kohles SS, Stach RM+. Five- Year Survival Distributions of Short-Length (10mm or less) Machined-Surfaced and OSSEOTITE Implants. Clinical Implant Dentistry and Related Research. 2004; Vol. 6, No. 1
Ellingsen JE, Johansson CB, Wennerberg A, Holmen A. Improved retention and bone- to- implant contact with fluori- de-modified titanium implants. Int J Oral Maxillofac Implants 2004;19(5):659–66
Buser et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: a retro- spective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 2012Dec;14(6):839–51.
Glauser, R. (2012). Eleven-year results of implants with an oxidi- zed surface placed predominantly in soft bone and subjected to immediate occlusal loading [#308]. 20th Anniversary Mee- ting of the European Association for Osseointegration. Copenhagen, Denmark, Wiley. 23: 140–141,



