Wieso bekommt man eine Parodontose?
Parodontitis bei mir? Ich putze doch!
Parodontitis entsteht nicht über Nacht. Sie ist das Ergebnis eines Prozesses, der sich über Monate bis Jahre entwickelt – meist unbemerkt, fast immer schmerzfrei. Am Ende steht der Verlust von Zähnen, die eigentlich gesund waren.
Die Entstehung folgt einer einfachen Formel: Bakterien + Immunreaktion + Zeit. Bakterielle Beläge lösen eine Entzündung aus. Der Körper reagiert mit einer Abwehrreaktion – und zerstört dabei sein eigenes Gewebe. Dieser Prozess ist das Kernproblem der Parodontitis: Nicht die Bakterien selbst zerstören den Knochen, sondern die überschießende Immunantwort des Körpers.
Die Kurzversion: Parodontitis in fünf Schritten
| Schritt | Was passiert | Reversibel? |
|---|---|---|
| 1. Plaque | Bakterien sammeln sich am Zahnfleischrand | ✓ Ja – durch Zähneputzen |
| 2. Gingivitis | Das Zahnfleisch entzündet sich | ✓ Ja – heilt vollständig aus |
| 3. Taschenbildung | Das Zahnfleisch löst sich vom Zahn | ✗ Nein – Übergang zur Parodontitis |
| 4. Knochenabbau | Der Kieferknochen wird abgebaut | ✗ Nein – irreversibel |
| 5. Zahnverlust | Der Zahn verliert seinen Halt | ✗ Nein – Endstadium |
Der Übergang von Gingivitis zu Parodontitis ist fließend. Solange nur das Zahnfleisch betroffen ist, heilt es nach Entfernung der Beläge vollständig aus. Wenn der Knochen beteiligt ist, wächst dieser nicht von selbst nach – aber der Prozess lässt sich stoppen. Je früher die Diagnose und Therapie erfolgt, desto sicherer kann man den Prozess zur Ausheilung bringen, Zähne erhalten und der Allgemeingesundheit einen grossen Dienst erweisen.
Mit den "falschen" Bakterien fängt es an
Das Ökosystem Mund
In Ihrem Mund leben etwa 700 verschiedene Bakterienarten – rund 100 Milliarden Einzelorganismen. Das klingt bedrohlich, ist aber normal. Die allermeisten dieser Bakterien sind harmlos oder sogar nützlich. Sie halten das Gleichgewicht der Mundflora aufrecht und schützen vor Krankheitserregern.
Problematisch wird es, wenn dieses Gleichgewicht kippt.
Dysbiose: Wenn das Gleichgewicht kippt
Der Fachbegriff dafür ist Dysbiose. Gemeint ist eine Verschiebung der Bakterienzusammensetzung hin zu krankmachenden Arten. Das passiert, wenn:
- Beläge nicht regelmäßig entfernt werden
- Die Immunabwehr geschwächt ist
- Risikofaktoren wie Rauchen oder Diabetes hinzukommen
Bei einer Dysbiose vermehren sich aggressive Bakterienarten, die normalerweise in der Minderheit sind. Sie verdrängen die harmlosen Arten und beginnen, das Gewebe anzugreifen.
Der Biofilm: Warum Bakterien in Gemeinschaft gefährlicher sind
Einzelne Bakterien wären für den Körper kein Problem – das Immunsystem würde sie schnell eliminieren. Die Gefahr entsteht, wenn sich Bakterien zu einem Biofilm organisieren.
Ein Biofilm ist eine strukturierte Gemeinschaft von Bakterien, eingebettet in eine selbst produzierte Schutzmatrix aus Zuckern, Proteinen und DNA. Diese Matrix macht den Biofilm extrem widerstandsfähig:
Ein Biofilm ist eine strukturierte Gemeinschaft von Bakterien, eingebettet in eine selbst produzierte Schutzmatrix aus Zuckern, Proteinen und DNA. Diese Matrix macht den Biofilm extrem widerstandsfähig:
- 10- bis 1000-fach höhere Resistenz gegen Antibiotika als frei schwimmende Bakterien
- Schutz vor dem Immunsystem – Abwehrzellen können den Biofilm nicht durchdringen
- Kommunikation und Arbeitsteilung – Bakterien im Biofilm koordinieren ihre Angriffe
Der Biofilm, den wir als Zahnbelag (Plaque) kennen, ist also keine passive Ansammlung von Bakterien, sondern eine hochorganisierte Struktur mit eigener Infrastruktur.
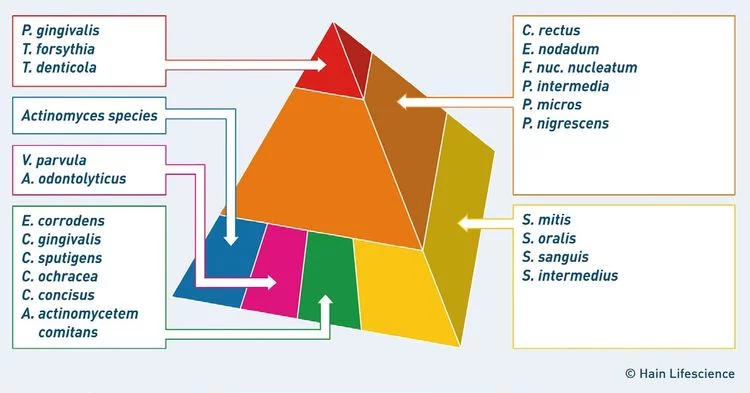
Die gefährlichsten Parodontitis-Bakterien: Der "rote Komplex"
Nicht alle Parodontitis-Bakterien sind gleich aggressiv. Die Wissenschaft hat sie nach ihrer Gefährlichkeit in farbcodierte Gruppen eingeteilt – die sogenannten Socransky-Komplexe.
| Komplex | Bakterien | Rolle |
|---|---|---|
| Gelb/Orange | Prevotella intermedia, Fusobacterium u.a. | „Wegbereiter“ – schaffen Bedingungen für aggressive Keime |
| Rot | Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola | Die „Haupttäter“ – verursachen schwere Gewebezerstörung |
| Grün | Aggregatibacter actinomycetemcomitans | Leitkeim bei aggressiven Verlaufsformen |
Die Bakterien des roten Komplexes sind anaerob – sie brauchen eine sauerstoffarme Umgebung. Diese finden sie in tiefen Zahnfleischtaschen. Das erklärt, warum Parodontitis sich selbst verstärkt: Je tiefer die Taschen, desto besser die Bedingungen für die aggressiveren Keime.
Unsere eigene Immunreaktion heizt die Parodontitis an
Hier liegt das Paradox der Parodontitis: Nicht die Bakterien zerstören den Knochen – der Körper tut es selbst.
Das Paradox der Selbstzerstörung
Wenn Bakterien das Gewebe angreifen, reagiert das Immunsystem mit einer Entzündungsreaktion. Abwehrzellen werden mobilisiert: Granulozyten, Makrophagen, T-Lymphozyten. Sie setzen Enzyme und Botenstoffe frei, um die Eindringlinge zu bekämpfen.
Das Problem: Diese Abwehrreaktion ist nicht präzise. Die freigesetzten Enzyme (Matrix-Metalloproteinasen) und Entzündungsbotenstoffe (Interleukine, TNF-α) zerstören nicht nur Bakterien, sondern auch körpereigenes Gewebe – Kollagenfasern, Halteapparat, Knochen.
Es entsteht ein Teufelskreis:
- Bakterien greifen an
- Immunsystem reagiert mit Entzündung
- Entzündung zerstört Gewebe
- Gewebezerstörung schafft tiefere Taschen
- In tieferen Taschen siedeln sich aggressivere Bakterien an
- Zurück zu Schritt 1 – mit verstärkter Intensität
Ohne Unterbrechung dieses Kreislaufs schreitet die Zerstörung fort, bis der Zahn seinen Halt verliert.
Manche Menschen stärker reagieren als andere
Nicht jeder Mensch mit Plaque entwickelt eine Parodontitis. Manche haben trotz mittelmäßiger Mundhygiene kaum Probleme, andere erkranken trotz guter Pflege schwer. Der Unterschied liegt in der individuellen Immunreaktion.
Bei manchen Menschen ist die Entzündungsreaktion genetisch bedingt stärker ausgeprägt. Bestimmte Genvarianten (Polymorphismen) führen zu einer erhöhten Produktion von Entzündungsbotenstoffen wie Interleukin-1. Das Immunsystem reagiert überschießend – und richtet entsprechend mehr Kollateralschaden an.
Das erklärt auch, warum Parodontitis familiär gehäuft auftritt. Nicht die Bakterien werden vererbt, sondern die Neigung zu einer überschießenden Immunantwort.
Die Parodontose Risikofaktoren: worauf haben wir Einfluss?
Mundhygiene – die Grundvoraussetzung
Ohne bakterielle Beläge keine Parodontitis. Mangelhafte Mundhygiene ist nicht nur ein Risikofaktor unter vielen, sondern die Basis der Erkrankung. Wer Plaque nicht regelmäßig entfernt, schafft die Voraussetzung dafür, dass sich aggressive Keime ansiedeln und vermehren können. Die gute Nachricht: Hier hat jeder selbst den größten Einfluss.
Bakterien und Immunreaktion sind die Grundvoraussetzungen. Risikofaktoren bestimmen, ob und wie schwer jemand erkrankt.
Rauchen – der stärkste beeinflussbareRisikofaktor
Raucher haben ein zwei- bis siebenfach erhöhtes Risiko für Parodontitis. Bei starken Rauchern (> 20 Zigaretten/Tag) kann das Risiko sogar 20-fach erhöht sein.
Warum Rauchen so schädlich ist:
- Durchblutung: Nikotin verengt die Blutgefäße. Das Zahnfleisch wird schlechter versorgt, die Immunabwehr geschwächt.
- Wundheilung: Die Regenerationsfähigkeit des Gewebes ist stark eingeschränkt.
- Maskierung: Weniger Durchblutung bedeutet weniger Zahnfleischbluten – das Warnsignal fehlt.
- Therapieerfolg: Raucher sprechen schlechter auf die Behandlung an. Die Rückfallquote ist höher.
Die gute Nachricht: Nach einem Rauchstopp verbessert sich die Prognose messbar. Das Gewebe regeneriert, die Therapie wird wirksamer.
Diabetes - Parodontitis - Wechselwirkung
Diabetes und Parodontitis verstärken sich gegenseitig. Diabetiker haben ein etwa dreifach erhöhtes Risiko für Parodontitis.
Diabetes → Parodontitis:
- Erhöhte Blutzuckerwerte fördern Entzündungen
- Die Wundheilung ist gestört
- Die Immunabwehr ist geschwächt
- Auch im Speichel ist der Zuckergehalt erhöht – Bakterien freuen sich
Parodontitis → Diabetes:
- Die chronische Entzündung erhöht die Insulinresistenz
- Die Blutzuckereinstellung wird schwieriger
- Parodontitistherapie kann den HbA1c um 0,3–0,4 Prozentpunkte senken
Für Diabetiker ist Parodontitis-Prävention und -Therapie deshalb besonders wichtig.
Eine Parodontitis ist auch genetisch veranlagt
Etwa 30–50 % des Parodontitis-Risikos sind genetisch bedingt. Bestimmte Genvarianten führen zu:
- Stärkerer Entzündungsreaktion (IL-1-Polymorphismus)
- Veränderter Immunantwort
- Gestörtem Bindegewebsstoffwechsel
Genetische Tests können das individuelle Risiko einschätzen – sie sind aber keine Routinediagnostik.
Stress
Chronischer Stress schwächt das Immunsystem und fördert Entzündungen. Studien zeigen einen klaren Zusammenhang zwischen psychischer Belastung und Parodontitis-Schwere. Stress führt außerdem oft zu vernachlässigter Mundhygiene und ungesünderer Lebensweise.
Weitere Faktoren
| Faktor | Mechanismus |
|---|---|
| Bruxismus | Knirschen/Pressen überlastet den Zahnhalteapparat und beschleunigt bei bestehender Entzündung den Knochenabbau |
| Übergewicht | Fettgewebe produziert Entzündungsbotenstoffe |
| Hormonelle Veränderungen | Schwangerschaft, Menopause erhöhen Entzündungsneigung |
| Medikamente | Einige Blutdrucksenker, Immunsuppressiva beeinflussen das Zahnfleisch |
| Alter | Risiko steigt mit den Jahren – längere Expositionszeit, veränderte Immunantwort |
| Mundatmung | Trocknet die Mundschleimhaut aus, reduziert die schützende Speichelwirkung |
| Plaqueretentionsstellen | Überstehende Füllungsränder, schlecht sitzender Zahnersatz, Engstände – hier sammelt sich Plaque, die schwer zu entfernen ist |
| HIV/AIDS | Geschwächte Immunabwehr |
| Mangelernährung | Vitamin-C-Mangel, Vitamin-D-Mangel |
Ist eine Parodontitis ansteckend?
Ja und nein.
Ja: Parodontitis-Bakterien können übertragen werden – durch Küssen, gemeinsames Besteck, von Eltern auf Kinder. Studien zeigen, dass Partner von Parodontitis-Patienten häufiger dieselben aggressiven Keime im Mund haben.
Nein: Die bloße Anwesenheit der Bakterien führt nicht automatisch zur Erkrankung. Entscheidend ist, ob das Immunsystem mit einer überschießenden Entzündung reagiert – und das ist individuell verschieden. Parodontitis ist nicht infektilös wie virale Erkrankunegn (Influenza, Covid etc.).
Praktische Konsequenz: Wenn bei einem Partner schwere Parodontitis festgestellt wird, sollte der andere sich ebenfalls untersuchen lassen. Eine „Mitbehandlung“ kann sinnvoll sein, um eine gegenseitige Wiederansteckung zu verhindern.
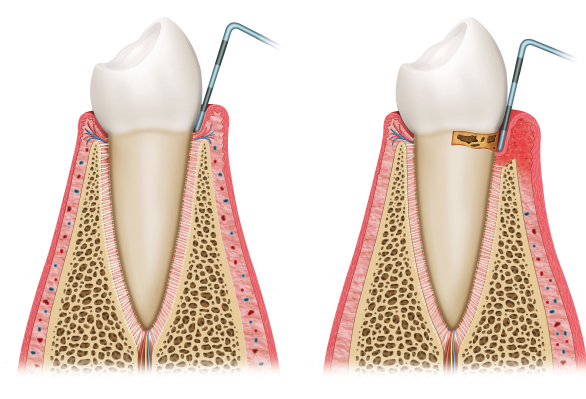
Wann wird aus einer Zahnfleischentzündung eine Parodontitis?
Die Zahnfleischentzündung (Gingivitis) ist das Vorstadium der Parodontitis – aber nicht jede Gingivitis wird zur Parodontitis. Der entscheidende Unterschied:
| Gingivitis | Parodontitis | |
|---|---|---|
| Betroffen | Nur das Zahnfleisch | Zahnfleisch + Knochen + Haltefasern |
| Taschentiefe | Bis 3 mm (Pseudotaschen) | Ab 4 mm (echte Taschen) |
| Knochenabbau | Nein | Ja |
| Reversibel | Vollständig | Nicht mehr |
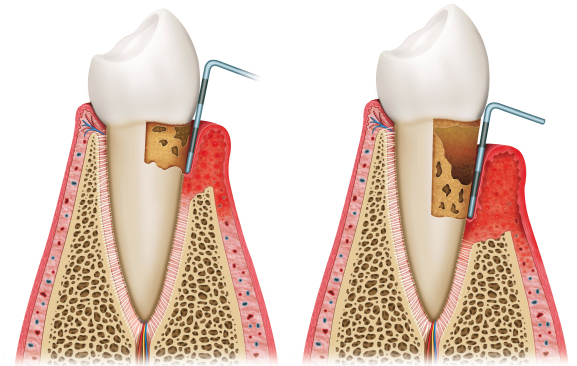
Der Übergang von Gingivitis zu Parodontitis ist der kritische Moment. Solange nur das Zahnfleisch betroffen ist, ist noch kein echter Schaden am Zahn entstanden – das Zahnfleisch regeneriert sich vollständig, sobald die Beläge entfernt werden. Die Gingivitis wir allerdings auch schon als Allgemeinerkrankungen eingestuft, da sie Entzündungswerte im Blut erhöht.
Sobald die Entzündung auf den Knochen übergreift, geht Knochen verloren. Die Behandlung kann den Prozess vollständig stoppen, der Knochen wächst von selbst aber nicht mehr nach.
Wie lange dauert der Übergang?
Das ist individuell sehr unterschiedlich und hängt von der Aggressivität der Bakterien, der Stärke der Immunreaktion und den vorhandenen Risikofaktoren ab.
- Bei chronischer Parodontitis (die häufigste Form) dauert der Übergang oft Jahre bis Jahrzehnte
- Bei aggressiven Verlaufsformen kann es Monate dauern
Das macht die Früherkennung so wichtig. Die Gingivitis ist das Warnsignal – wer hier handelt, kann die Parodontitis verhindern.
Warum gute Mundhygiene nicht immer reicht
Eine häufige Frustration: „Ich putze doch gründlich – warum habe ich trotzdem Parodontitis?“
Die Antwort liegt im Zusammenspiel der Faktoren:
- Mundhygiene ist notwendig, aber nicht hinreichend. Sie reduziert die Bakterienlast, kann aber genetische Veranlagung oder andere Risikofaktoren nicht ausgleichen.
- Bestimmte Stellen sind schwer erreichbar. Zahnzwischenräume, Zahnfleischrand, Weisheitszähne – hier sammelt sich Plaque, auch bei sorgfältigem Putzen.
- Der Biofilm ist hartnäckig. Einmal etabliert, lässt er sich mit der Zahnbürste nicht vollständig entfernen. Professionelle Reinigung ist notwendig.
- Die Immunreaktion ist individuell. Manche Menschen reagieren stärker auf dieselbe Bakterienmenge.
Deshalb ist die Kombination entscheidend: gute häusliche Mundhygiene plus regelmäßige professionelle Reinigung plus Kontrolle der Risikofaktoren.
implantate.com-Fazit:
Parodontitis entsteht nicht durch einen einzelnen Faktor, sondern durch das Zusammenspiel von Bakterien, Immunreaktion und Risikofaktoren über einen längeren Zeitraum.
Die wichtigste Erkenntnis: Der Körper zerstört sich selbst – die Bakterien sind nur der Auslöser, die überschießende Immunantwort ist der eigentliche Zerstörer. Das erklärt, warum manche Menschen trotz schlechter Mundhygiene kaum Probleme haben, während andere trotz guter Pflege schwer erkranken.
Der zweite wichtige Punkt: Es gibt einen „Point of no return“. Solange nur das Zahnfleisch betroffen ist (Gingivitis), ist alles noch heilbar. Sobald der Knochen angegriffen wird, ist der Schaden irreversibel. Früherkennung entscheidet.
Literaturangaben
Pathogenese und Biofilm:
Darveau RP: Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol 2010;8(7):481–490.
Hajishengallis G, Lamont RJ: Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Mol Oral Microbiol 2012;27(6):409–419.
List WF, Current concepts regarding the pathogenesis of periodontitis. Br Dent J 2018;224(1):16–24.
Bakterienkomplexe:
Bergström J: Tobacco smoking and chronic destructive periodontal disease. Odontology 2004;92(1):1–8.
Taylor GW, Borgnakke WS: Periodontal disease: associations with diabetes, glycemic control and complications. Oral Dis 2008;14(3):191–203.
Loos BG, Van Dyke TE: The role of inflammation and genetics in periodontal disease. Periodontol 2000 2020;83(1):26–39.
DG PARO et al.: S3-Leitlinie Behandlung von Parodontitis Stadium I–III. AWMF-Register Nr. 083-043. 2020/2021.
Bildnachweis: Socransky Komplex Markerkeime mit freundlicher Genehmigung von Hain Lifescience