Porphyromonas gingivalis (P.g.): Leitkeim der schweren Parodontitis
Porphyromonas gingivalis ist in geringer Zahl bei fast allen Menschen in der Mundhöhle (Mundflora) nachweisbar. Sein bloßes Vorhandensein ist noch kein Grund zur Beunruhigung. Entscheidend ist die Kombination aus Keimmenge, klinischem Befund (Taschentiefen, Blutung, Knochenabbau) und dem Ansprechen auf die bisherige Behandlung.
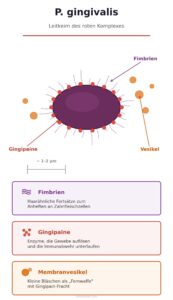
P. gingivalis ist der am besten erforschte und klinisch bedeutsamste Markerkeim der Parodontitis – der Anführer des sogenannten roten Komplexes und damit Teil der aggressivsten Bakteriengruppe, die in Zahnfleischtaschen nachgewiesen werden kann. Was P.g. von anderen Parodontitis-Keimen unterscheidet: Er richtet nicht nur selbst Schaden an, sondern manipuliert das Immunsystem so, dass die körpereigene Abwehr den Zahnhalteapparat zusätzlich zerstört. Je stärker die Entzündung, desto besser seine Lebensbedingungen. Das macht ihn zu einem Gegner, den der Körper ohne zahnärztliche Behandlung selten unter Kontrolle bekommt.
Steckbrief Porphyromonas gingivalis
| Abkürzung | P.g. |
| Komplex | Roter Komplex (zusammen mit T. forsythia und T. denticola) |
| Sauerstoffbedarf | Strikt anaerob – überlebt nur ohne Sauerstoff |
| Lebensraum | Tiefe Zahnfleischtaschen (ab ca. 4–5 mm), unterhalb des Zahnfleischsaums |
| Hauptwaffe | Gingipaine – Enzyme, die Gewebe auflösen und das Immunsystem unterlaufen |
| Besonderheit | Kann die schützende Zellschicht des Zahnfleischs durchdringen und sich im tieferen Gewebe einnisten |
| Klinische Bedeutung | Leitkeim bei schweren Formen der Parodontitis (Stadium III/IV). Nachweis fast immer verbunden mit tiefen Taschen, Blutung auf Sondierung und aktivem Knochenabbau |
| Wirksame Antibiotika | Metronidazol, Clindamycin, Doxycyclin (Reserve) |
| Nachweisbar über | Markerkeimtest (DNA-Analyse aus Zahnfleischtaschenflüssigkeit) |
| Früherer Name | Bacteroides gingivalis (bis 1986) |
Wie P. gingivalis den Zahnhalteapparat zerstört
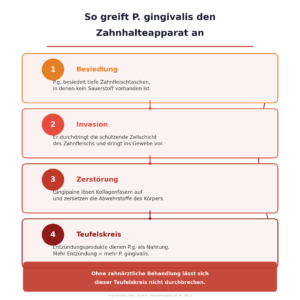
Die meisten Bakterien in der Mundhöhle sitzen auf der Zahnoberfläche und lassen sich durch Zähneputzen und professionelle Reinigung entfernen. P. gingivalis kann mehr: Er durchdringt die schützende Zellschicht des Zahnfleischs – das sogenannte Taschenepithel – und nistet sich im darunterliegenden Bindegewebe ein. Dort ist er für Zahnbürste und Mundspülung unerreichbar, und selbst die mechanische Reinigung der Wurzeloberflächen durch den Zahnarzt stößt hier an ihre Grenzen.
Einmal im Gewebe angekommen, setzt P. gingivalis seine wichtigste Waffe ein: Gingipaine. Das sind Enzyme, die gleich mehrere Dinge gleichzeitig tun:
Sie lösen Gewebe auf. Gingipaine spalten die Kollagenfasern, die den Zahn im Knochen verankern. Das Ergebnis ist ein fortschreitender Abbau des Zahnhalteapparats – genau das, was man bei einer Parodontitis als Attachmentverlust misst.
Sie unterlaufen die Immunabwehr. Gingipaine zerlegen Antikörper und Abwehrstoffe, die der Körper gegen die Bakterien schickt. Die Immunabwehr wird nicht ausgeschaltet, aber in die Irre geführt: Sie läuft auf Hochtouren, ohne den Keim effektiv zu bekämpfen.
Sie sorgen für Nahrung. Die freigesetzten Gewebeabbauprodukte dienen P. gingivalis als Nährstoffquelle. Je stärker die Entzündung, desto mehr Gewebe wird abgebaut, desto mehr Nahrung steht zur Verfügung. Ein Teufelskreis: Der Keim profitiert von genau der Entzündung, die er selbst provoziert.
Diesen Mechanismus – eine Entzündungsreaktion, die dem Erreger nützt statt ihm zu schaden – nennt die Forschung „destruktive Entzündung“. P. gingivalis ist darin besonders effektiv, weshalb er in der Fachliteratur als „Keystone-Pathogen“ bezeichnet wird: ein Keim, der auch in geringer Zahl das gesamte Ökosystem der Zahnfleischtasche so umorganisieren kann, dass die Krankheit fortschreitet.
P. gingivalis umacht krank
In den letzten Jahren hat P. gingivalis über die Zahnmedizin hinaus Aufmerksamkeit erregt. Der Grund: Forscher haben DNA und Stoffwechselprodukte dieses Keims in Geweben gefunden, die weit von der Mundhöhle entfernt liegen – in Blutgefäßen, in Gelenkflüssigkeit und im Gehirn.
Die Studienlage im Überblick:
Alzheimer: 2019 wiesen Forscher Gingipaine – also das Hauptenzym von P. gingivalis – im Gehirn und in der Rückenmarksflüssigkeit von Alzheimer-Patienten nach Der Verdacht: P. gingivalis gelangt über die Blutbahn ins Gehirn und trägt dort zu den für Alzheimer typischen Entzündungsprozessen bei. Die Forschung ist vielversprechend, aber noch nicht abgeschlossen. Ein kausaler Beweis – „P. gingivalis verursacht Alzheimer“ – liegt allerdings noch nicht vor.
Herz-Kreislauf-Erkrankungen: DNA von P. gingivalis wurde in atherosklerotischen Plaques (Gefäßablagerungen) nachgewiesen. Epidemiologische Studien zeigen eine Assoziation zwischen schwerer Parodontitis und erhöhtem Risiko für Herzinfarkt und Schlaganfall. Ob die Parodontitis-Behandlung das kardiovaskuläre Risiko senkt, ist Gegenstand laufender Untersuchungen.
Rheumatoide Arthritis: P. gingivalis kann ein Enzym produzieren (Peptidylarginin-Deiminase), das körpereigene Proteine so verändert, dass das Immunsystem sie angreift – ein Mechanismus, der auch bei der rheumatoiden Arthritis eine Rolle spielt. Die Assoziation ist gut belegt, die Kausalität wird diskutiert.
Für Patienten bedeutet das: Eine unbehandelte Parodontitis ist nicht nur ein Problem für die Zähne. Die erfolgreiche Behandlung der Parodontitis kann daher über die Mundgesundheit hinaus von Bedeutung sein.
Ausführlich im Kapitel [Parodontitis und Allgemeingesundheit]
Behandlung bei P. gingivalis-Nachweis
Wurde P. gingivalis in hoher Konzentration nachgewiesen und liegt gleichzeitig eine schwere Parodontitis vor (Stadium III oder IV), dürfte eine begleitende Antibiotikatherapie sinnvoll sein – in der Regel mit Metronidazol. Die aktuelle S3-Leitlinie empfiehlt systemische Antibiotika allerdings nicht routinemäßig, sondern nur bei generalisierten Formen, die auf die mechanische Behandlung allein nicht ausreichend ansprechen.
Die Therapie unterscheidet sich im Grundsatz nicht von der Standardbehandlung der Parodontitis: Die mechanische Reinigung der Wurzeloberflächen (Scaling und Root Planing) ist und bleibt die tragende Säule. Sie entfernt den Biofilm und die Konkremente, die P. gingivalis seinen Lebensraum bieten.
Was bei P. gingivalis besonders relevant ist:
Die Tatsache, dass P. gingivalis in das Gewebe eindringen kann, macht die gründliche Nachsorge (UPT – unterstützende Parodontitistherapie) besonders wichtig. Keime, die im Gewebe sitzen, werden durch eine einmalige Reinigung nicht vollständig eliminiert. Erst die regelmäßige Wiederholung – typischerweise alle drei bis sechs Monate – sorgt dafür, dass sich der Biofilm nicht erneut in krankmachender Zusammensetzung aufbaut.
Wenn eine begleitende Antibiotikatherapie indiziert ist, stehen für P. gingivalis folgende Optionen zur Verfügung:
| Antibiotikum | Einsatz | Anmerkung |
|---|---|---|
| Metronidazol | Mittel der Wahl | Wirksam gegen anaerobe Keime des roten Komplexes |
| Metronidazol + Amoxicillin | Bei gleichzeitigem A.a.-Nachweis | Van-Winkelhoff-Kombination, häufigste Kombitherapie |
| Clindamycin | Alternative bei Unverträglichkeit | Breiteres Wirkspektrum, mehr Nebenwirkungen |
| Doxycyclin | Reservepräparat | Auch immunmodulatorische Wirkung in Niedrigdosis |
Der Nachweis von P. gingivalis ist immer ein Signal dafür, dass die Nachsorge besonders wichtig ist. Patienten mit P. gingivalis im Biofilm haben ein höheres Risiko für ein Wiederaufflammen der Erkrankung, wenn die Nachsorge vernachlässigt wird.
implantate.com-Fazit
P. gingivalis ist der klinisch bedeutsamste Markerkeim der Parodontitis. Er durchdringt die Zahnfleischschutzschicht, zerstört Kollagenfasern und nutzt die Entzündung, die er selbst auslöst, als Nahrungsquelle. Ohne zahnärztliche Behandlung lässt sich dieser Teufelskreis nicht durchbrechen. Gerade bei P. gingivalis-Nachweis gilt: Die konsequente Nachsorge ist der wichtigste Schutz vor einem Rückfall.
Dewhirst FE, Chen T, Izard J et al.: The Human Oral Microbiome. J Bacteriol 2010; 192(19):5002–5017.
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.