Parodontitis, Gelenke und Rheuma
RA und Risiko bei Endoprothesen
Parodontitis und Gelenkerkrankungen haben auf den ersten Blick wenig gemeinsam – die eine befällt den Zahnhalteapparat, die andere die Gelenke. Doch die Forschung der letzten Jahre hat aufgedeckt, dass sie weit mehr verbindet als der Zufall: Ein bestimmtes Bakterium aus dem Mund könnte die Autoimmunreaktion auslösen, die zur Gelenkzerstörung bei rheumatoider Arthritis führt. Und wenn ein geschädigtes Gelenk irgendwann durch eine Prothese ersetzt werden muss, werden die gleichen Mundbakterien erneut zum Problem – als mögliche Auslöser einer Protheseninfektion.
Parodontitis und rheumatoide Arthritis: häufiger als erwartet
Menschen mit Parodontitis haben ein 2- bis 8-fach erhöhtes Risiko, an rheumatoider Arthritis (RA) zu erkranken. Die Spannbreite der Zahlen spiegelt unterschiedliche Studiendesigns wider, doch die Richtung ist eindeutig.
Umgekehrt leiden RA-Patienten deutlich häufiger an Parodontitis als Gesunde – selbst bei vergleichbarer Mundhygiene. Es liegt also nicht daran, dass Rheumapatienten schlechter putzen. Vielmehr scheinen beide Erkrankungen gemeinsame immunologische Wurzeln zu haben.
Die deutsche CAPEA-Studie (Course And Prognosis of Early Arthritis) lieferte dazu aufschlussreiche Daten: In der Kohorte von über 1.100 Patienten mit früher rheumatoider Arthritis zeigte sich ein klarer Zusammenhang zwischen Zahnverlust – einem Marker für Parodontitis – und höherer Krankheitsaktivität sowie erhöhten Entzündungswerten. Die parodontale Belastung war also nicht Folge einer jahrelangen Rheumatherapie, sondern bereits zu Beginn der Gelenkerkrankung nachweisbar.
Parodontitis Leitkeime triggern Citrullinierung: Autoantikörper als molekularer Schlüssel
Der spannendste Aspekt der Parodontitis-Rheuma-Verbindung ist ein molekularer Mechanismus, der das Potenzial hat, unser Verständnis der rheumatoiden Arthritis grundlegend zu verändern.
Porphyromonas gingivalis, der Leitkeim der Parodontitis, besitzt ein Enzym namens Peptidyl-Arginin-Deiminase (PAD). Dieses Enzym verändert körpereigene Proteine durch einen Prozess namens Citrullinierung: Die Aminosäure Arginin wird in Citrullin umgewandelt. Das klingt harmlos, hat aber gravierende Folgen.
Das Immunsystem erkennt die citrullinierten Proteine als fremd und bildet Autoantikörper dagegen – die sogenannten ACPA (Anti-Citrullinated Protein Antibodies), auch CCP-Antikörper genannt. Genau diese Antikörper sind ein Hauptmarker für die rheumatoide Arthritis. Sie finden sich bei etwa 50 bis 80 Prozent der RA-Patienten im Blut und können der klinischen Erkrankung um Jahre vorausgehen.
Die Hypothese lautet: Die Parodontitis-Bakterien könnten über die Citrullinierung den ersten Anstoß zur Autoimmunreaktion geben, die letztlich zur Gelenkzerstörung führt. Oder sie könnten bei genetisch prädisponierten Personen eine schwelende Autoimmunreaktion verstärken und zum Ausbruch bringen.
2010 wiesen Wegner und Kollegen nach, dass P. gingivalis menschliches Fibrinogen und α-Enolase citrullinieren kann – zwei Proteine, die als Zielstrukturen der ACPA bei rheumatoider Arthritis bekannt sind. 2016 wurde ein weiteres Bakterium identifiziert, das citrulliniert: Aggregatibacter actinomycetemcomitans, ebenfalls ein Parodontitis-Keim. Dieser Keim löst die Citrullinierung über einen anderen Mechanismus aus – er bildet Leukotoxin A, das in Immunzellen eine unkontrollierte Citrullinierung auslöst. Damit gibt es mindestens zwei Parodontitis-Bakterien, die die Autoimmunkaskade anstoßen können.
Gemeinsame Entzündungsmuster von Parodontitis und RA
Jenseits der Citrullinierung teilen Parodontitis und rheumatoide Arthritis auffällig ähnliche Entzündungsmuster. In beiden Erkrankungen spielen die gleichen Immunzellen und Botenstoffe die Hauptrolle.
TNF-alpha ist der zentrale Entzündungstreiber bei rheumatoider Arthritis – so zentral, dass die erfolgreichsten Rheuma-Medikamente (TNF-Blocker wie Adalimumab oder Etanercept) genau diesen Botenstoff ausschalten. TNF-alpha ist auch bei Parodontitis stark erhöht. IL-17, ein Botenstoff der T-Helferzellen vom Typ 17, fördert sowohl den Knochenabbau in den Gelenken als auch den Knochenabbau im Kiefer. RANKL (Receptor Activator of NF-κB Ligand) aktiviert die Osteoklasten – jene Zellen, die Knochen abbauen – und ist bei beiden Erkrankungen überexprimiert. Matrix-Metalloproteinasen (MMPs) schließlich zerstören das Bindegewebe – im Gelenk den Knorpel, im Mund den Zahnhalteapparat.
Diese Parallelen deuten auf gemeinsame pathogenetische Wege hin, die beide Erkrankungen miteinander verbinden.
Kann eine Parodontose-Behandlung die Rheuma-Aktivität verringern?
Wenn die Parodontitis die rheumatoide Arthritis tatsächlich befeuert, sollte ihre Behandlung auch die Gelenkerkrankung bessern. Genau das zeigen mehrere Studien.
Eine Metaanalyse von Kaur et al. (2014) fasste die verfügbaren Interventionsstudien zusammen: Nach einer systematischen Parodontitis-Behandlung verbesserte sich der DAS28-Score (Disease Activity Score, der Standardindex zur Beurteilung der Rheuma-Aktivität) signifikant. Die Entzündungsmarker im Blut – CRP und BSG – sanken ebenfalls. In einigen Studien verbesserten sich auch subjektive Parameter wie Morgensteifigkeit und Schmerzintensität. Die Patienten fühlten sich im Alltag besser.
Diese Ergebnisse haben die rheumatologischen Fachgesellschaften aufmerksam gemacht. Zunehmend wird gefordert, die Mundgesundheit in die rheumatologische Behandlung zu integrieren.
Schaden Rheuma-Medikamente dem Zahnfleisch? Ein überraschendes Bild
Wenn Parodontitis und rheumatoide Arthritis gemeinsame Entzündungswege teilen, liegt eine Frage nahe: Wirken die Rheuma-Medikamente dann auch auf das Zahnfleisch?
Die Antwort ist überraschend – und für Patienten eher beruhigend als beunruhigend. Ein systematisches Review von Petit et al. (2024) wertete 35 Studien zu dieser Frage aus. Das Ergebnis im Überblick:
Methotrexat (MTX), das am häufigsten eingesetzte Basismedikament bei RA, schadet dem Zahnfleisch in der Regel nicht. Im Gegenteil: In einer Mausstudie (Lübcke et al. 2019, Universität Rostock) verbesserte MTX sogar den Alveolarknochenabbau bei experimenteller Parodontitis. Das passt zum heutigen Verständnis der Parodontitis als immunologisch fehlgesteuerte Entzündung: Wenn die Gewebezerstörung im Mund wesentlich durch eine überschießende Immunantwort getrieben wird, kann ein Immunmodulator wie MTX diesen Prozess theoretisch bremsen – im Kiefer genauso wie im Gelenk. Orale Mukositis (schmerzhafte Mundschleimhautulzerationen) tritt unter MTX zwar auf, aber fast ausschließlich bei versehentlicher Überdosierung oder fehlendem Folsäureschutz – nicht bei korrekt dosierter Rheumatherapie.
Biologika als Monotherapie (TNF-Blocker wie Adalimumab, IL-6-Hemmer wie Tocilizumab) zeigten in Studien bis zu sechs Monaten sogar einen positiven Effekt auf Taschentiefen und gingivale Entzündung. Auch das ist plausibel: Wenn TNF-alpha bei Parodontitis genauso eine zentrale Rolle spielt wie bei der RA, sollte seine Blockade in beiden Geweben wirken.
Auffällig ist eine Ausnahme: Die Kombination von TNF-Blockern mit MTX war in einer Querschnittstudie (Ziebolz et al. 2018) mit einem Anstieg der gingivalen Entzündung assoziiert. Die Gründe dafür sind unklar – möglicherweise spielt die stärkere Immunsuppression eine Rolle, oder die Patienten dieser Gruppe hatten von vornherein eine schwerere Grunderkrankung.
Glukokortikoide (Cortison) und NSAR zeigten bei den üblichen Dosierungen keinen relevanten Einfluss auf das Parodont.
Für die Praxis bedeutet das: Die Rheumatherapie ist kein Grund zur Sorge um das Zahnfleisch – sie könnte ihm sogar nützen. Entscheidend bleibt, dass der Zahnarzt über alle Medikamente informiert ist, insbesondere wenn chirurgische Eingriffe im Mund geplant sind. Denn auch wenn die Medikamente das Parodont nicht schädigen, beeinflussen sie die Wundheilung und die Infektabwehr.
Parodontitis als Risiko für künstliche Gelenke
Mundbakterien als Risiko für Gelenkprothesen
Rheumapatienten brauchen überproportional häufig einen Gelenkersatz. Und genau dann wird die Parodontitis zum doppelten Problem: nicht nur als möglicher Treiber der Grunderkrankung, sondern auch als Bakterienreservoir, das die Prothese gefährden kann.
Eine periprothetische Infektion (PJI) gehört zu den schwerwiegendsten Komplikationen nach Gelenkersatz. Sie tritt bei 0,3 bis 2 Prozent der Erstimplantationen auf und erfordert häufig aufwändige Revisionsoperationen mit monatelanger Antibiotikatherapie. Etwa 6 bis 13 Prozent dieser Infektionen werden oralen Keimen zugeschrieben – darunter Streptokokken, Peptostreptokokken und Actinomyces-Arten, die typischerweise aus der Mundhöhle stammen. Die Bakterien gelangen über die Blutbahn an die Prothesenoberfläche, wo sie Biofilme bilden können.
|
Antibiotika bei Zahnbehandlungen: hilft das?
Lange galt die Empfehlung, Patienten mit künstlichen Gelenken vor zahnärztlichen Eingriffen ein Antibiotikum zu verabreichen. Die Logik dahinter: Blutige Zahnbehandlungen können eine Bakteriämie auslösen – Bakterien gelangen vorübergehend in den Blutkreislauf. Dort könnten sie sich an der Prothesenoberfläche festsetzen.
Die Studienlage spricht allerdings gegen diesen Ansatz. Eine Meta-Analyse aus dem Jahr 2025 wertete vier große Kohortenstudien mit insgesamt über 157.000 Patienten aus: Die Antibiotikaprophylaxe vor Zahnbehandlungen senkte das Infektionsrisiko für Gelenkprothesen nicht. Auch die aktuelle klinische Praxisleitlinie der amerikanischen Orthopäden- und Zahnärztegesellschaften (AAOS/ADA, veröffentlicht November 2024) kommt zu dem Schluss, dass eine routinemäßige Antibiotikaprophylaxe vor zahnärztlichen Eingriffen bei Prothesenträgern nicht empfohlen wird. Die niederländische Leitlinie (Rademacher et al. 2017) war bereits Jahre zuvor zur gleichen Einschätzung gelangt.
Parodontitis therapieren statt Antibiotika bei Zahnarztbesuchen
Was die Leitlinien stattdessen empfehlen: eine gute Mundhygiene und regelmäßige zahnärztliche Kontrolle. Zwischen einer invasiven Zahnbehandlung und einem geplanten Gelenkersatz sollte ein zeitlicher Abstand eingehalten werden.
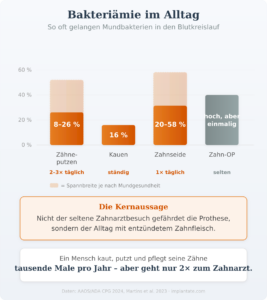
Die entscheidende Erkenntnis aus neueren Studien: Nicht die einzelne Zahnbehandlung ist das Hauptproblem, sondern der dauerhafte Entzündungsherd im Mund. Patienten mit unbehandelter Parodontitis – also blutendem Zahnfleisch, vertieften Taschen und bakteriellen Belägen – haben ein permanent erhöhtes Risiko für Bakteriämien. Die Zahlen sind eindrücklich: Schon ganz alltägliche Aktivitäten spülen Bakterien in den Blutkreislauf – 8 bis 26 Prozent beim Zähneputzen, 16 Prozent beim Kauen, 20 bis 58 Prozent bei der Verwendung von Zahnseide. Bei Zahnfleischentzündungen (Gingivitis) steigen diese Raten weiter an, weil das Gewebe durchlässiger wird. Nicht eine einzelne Zahnbehandlung, sondern diese tägliche, niedrigschwellige Belastung stellt das eigentliche Risiko für die Prothese dar.
Ob ein formales zahnärztliches Screening vor der Gelenkoperation die PJI-Rate tatsächlich senkt, ist wissenschaftlich bislang nicht ausreichend belegt – die wenigen Studien dazu sind von niedriger Qualität. Dennoch bleibt die Empfehlung bestehen, eine bestehende Parodontitis vor dem Gelenkersatz zu behandeln. Die biologische Plausibilität ist hoch, und das Risiko der Nichtbehandlung überwiegt.
Was Rheuma-Patienten und Endoprothesenträger mit Zahnfleischerkrankungen wissen sollten
Sie haben Rheuma?
Rheumapatienten gehören in engmaschige zahnärztliche Kontrolle – nicht nur wegen der Zähne, sondern weil die Mundgesundheit die Gelenkerkrankung beeinflusst. Nachsorgetermine im Abstand von drei bis vier Monaten sind empfehlenswert. Informieren Sie Ihren Zahnarzt über Ihre Rheuma-Medikamente, besonders wenn eine Parodontitis-Behandlung oder ein chirurgischer Eingriff geplant ist.
Sie haben Parodontitis und Gelenkbeschwerden?
Bei symmetrischen Schwellungen der kleinen Finger- oder Zehengelenke, Morgensteifigkeit über 30 Minuten oder anhaltenden Gelenkschmerzen sollte an eine rheumatologische Abklärung gedacht werden. Ein CCP-Antikörper-Test beim Hausarzt kann erste Hinweise geben.
Ihnen steht ein Gelenkersatz bevor?
Lassen Sie Ihren Zahnstatus vor der Gelenkoperation vom Zahnarzt – nicht nur vom Orthopäden – überprüfen. Eine bestehende Parodontitis sollte vor dem Eingriff behandelt werden. Das ist für die Langlebigkeit der Prothese wichtiger als die einmalige Antibiotikagabe vor einer Zahnbehandlung. Die beste Fürsorge für den Gelenkersatz beginnt mit einer gründlichen Mundhygiene und regelmäßigen Zahnarztbesuchen – nicht erst nach der Operation, sondern idealerweise schon Monate davor.
implantate.com-Fazit:
Die Verbindung zwischen Parodontitis und Gelenkproblemen reicht tiefer als lange angenommen. Bei der rheumatoiden Arthritis können Bakterien aus dem Mund eine Autoimmunerkrankung in den Gelenken auslösen oder verstärken. Bei künstlichen Gelenken sind dieselben Mundbakterien als Infektionsquelle relevant – wobei nicht die einzelne Zahnbehandlung, sondern die chronische Parodontitis das eigentliche Risiko darstellt.
Parodontitis und rheumatoide Arthritis
Kaur S, Bright R, Proudman SM, Bartold PM: Does periodontal treatment influence clinical and biochemical measures for rheumatoid arthritis? A systematic review and meta-analysis. Semin Arthritis Rheum 2014;44(2):113–122.
Albrecht K, de Pablo P, Eidner T et al.: Association between rheumatoid arthritis disease activity and periodontitis defined by tooth loss. Arthritis Care Res 2025;77(2):169–177.
de Pablo P, Dietrich T, McAlindon TE: Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population. J Rheumatol 2008;35(1):70–76.
Parodontitis und künstliche Gelenke
Patel R: Periprosthetic Joint Infection. N Engl J Med 2023;388(3):251–262.
Schmalz G: The hypotheses of oral disease-associated periprosthetic joint infections to understand the role of oral health for endoprostheses – a narrative review. Spec Care Dentist 2024;44(1):e12901.
Rheuma-Medikamente und Parodontitis