Tannerella forsythia (T.f.) Parodontitis Leitkeim
Manager des roten Komplex
Tannerella forsythia ist der dritte im Bund des roten Komplexes – und der am wenigsten bekannte. Keine spektakuläre Beweglichkeit wie Treponema denticola, kein berühmter Ruf wie Porphyromonas gingivalis. T.f. arbeitet im Hintergrund: Er verstärkt die Wirkung seiner Partner, schützt den Biofilm vor der körpereigenen Abwehr und macht die Erkrankung hartnäckiger. Sein Nachweis ist fast immer ein Zeichen dafür, dass sich der rote Komplex vollständig etabliert hat.
Steckbrief Tannerella forsythia
| Vollständiger Name | Tannerella forsythia |
| Früherer Name | Bacteroides forsythus (bis 2003) |
| Abkürzung | T.f. |
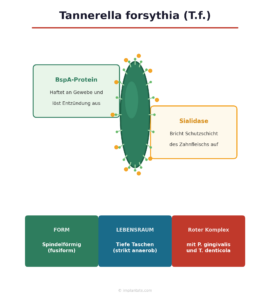
| Form | Spindelförmig (fusiform), pleomorph |
| Sauerstoff | Strikt anaerob – lebt nur ohne Sauerstoff |
| Komplex | Roter Komplex (mit P. gingivalis und T. denticola) |
| Besonderheit | Kann einen essenziellen Zellwandbaustein nicht selbst herstellen und ist auf Nachschub durch andere Biofilm-Bakterien angewiesen |
| Nachweis | Bakterieller Markerkeimtest (PCR) aus Sulkusflüssigkeit |
| Antibiotikum der Wahl | Metronidazol, ggf. in Kombination mit Amoxicillin |
Was sind die Kennzeichen des Bakteriums T. forsythia?
T.f. gehört zu den gram-negativen, strikt anaeroben Bakterien und besiedelt wie seine roten-Komplex-Partner ausschließlich tiefe, sauerstoffarme Zahnfleischtaschen. Seine Zellform ist ungewöhnlich: spindelförmig, an beiden Enden zugespitzt, und je nach Wachstumsbedingungen variabel in der Gestalt – Mikrobiologen nennen das pleomorph.
Was T.f. von anderen Markerkeimen grundlegend unterscheidet: Er kann den Zellwandzucker N-Acetylmuraminsäure (MurNAc) nicht selbst herstellen – einen Baustein, den praktisch alle anderen Bakterien eigenständig produzieren. T.f. ist darauf angewiesen, diesen Zucker von benachbarten Bakterien im Biofilm aufzunehmen, die ihn beim natürlichen Zellwandumbau freisetzen (Wyss, 1989). Diese Abhängigkeit erklärt, warum T.f. im Labor nur schwer isoliert zu kultivieren ist und warum er in der Mundhöhle fast ausschließlich in reifen, artenreichen Biofilmen auftritt – dort, wo auch P. gingivalis und andere Keime bereits vorhanden sind.
Ein isolierter T.f.-Befund ohne P. gingivalis ist entsprechend selten. Wenn T.f. nachgewiesen wird, ist der rote Komplex in der Regel vollständig präsent.
T. forsythia.stablisiert den roten Komplex
Innerhalb des roten Komplexes hat T.f. eine spezifische Rolle: Er verstärkt den Biofilm und schützt ihn vor dem Immunsystem des Körpers. Das geschieht auf mehreren Wegen:
BspA – das Oberflächenprotein als Multiwerkzeug. T.f. trägt auf seiner Oberfläche ein Protein namens BspA (Bacteroides surface protein A). Dieses Protein hat zwei Funktionen: Es hilft T.f., sich an andere Bakterien im Biofilm und an Gewebezellen anzuheften – und es aktiviert gleichzeitig über den Toll-like-Rezeptor 2 (TLR2) eine Entzündungsreaktion im Zahnfleisch. Die resultierende überschießende Immunantwort schädigt das umliegende Gewebe, ohne den Keim selbst zu eliminieren (Onishi et al., 2008).
Sialidase – Zugang durch Gewebezerstörung. T.f. produziert das Enzym Sialidase, das Sialinsäure-Reste von Zelloberflächen und Gewebeproteinen abspaltet. Das klingt technisch, hat aber eine klare Konsequenz: Die schützende Schleimschicht des Zahnfleisches wird aufgebrochen, was anderen Keimen das Eindringen ins Gewebe erleichtert und die lokale Entzündung verstärkt.
Zelltod in Fibroblasten und Immunzellen. T.f.-Lipoproteinfraktionen können in gingivalen Fibroblasten und Immunzellen den programmierten Zelltod auslösen – über die Aktivierung von Caspase-8 (Sharma, 2010). In Makrophagen wurde zusätzlich eine entzündungsbedingte Form des Zelltods (Pyroptose) nachgewiesen. Das führt dazu, dass das Stützgewebe des Zahnhalteapparats an Substanz verliert – auch ohne direkte mechanische Zerstörung durch Enzyme.
|
Erschwerte Therapie wenn T. forsythia mitmischt
Die Abhängigkeit von anderen Biofilm-Bakterien hat eine praktische Konsequenz für die Therapie: Solange der Biofilm insgesamt nicht effektiv gestört wird, kann auch T.f. nicht dauerhaft zurückgedrängt werden. Die mechanische Reinigung der Zahnfleischtaschen – Scaling und Root Planing – muss gründlich genug sein, um den gesamten roten Komplex zu stören, nicht nur einzelne Arten.
Gleichzeitig ist T.f. wie seine Partner empfindlich gegenüber Sauerstoff. Professionelle Reinigung, die den Biofilm aufbricht und belüftet, entzieht T.f. unmittelbar seinen Lebensraum. Dieser Mechanismus ist einer der Gründe, warum konsequente Nachsorge so entscheidend ist: Ohne regelmäßige Reinigung kann sich der rote Komplex – und damit T.f. – innerhalb weniger Monate wieder etablieren.
Ist ein Markerkeimtest auf T.f. bei Verdacht empfohlen?
T.f. wird standardmäßig in allen gängigen Markerkeimtests erfasst, da er zum roten Komplex gehört. Die Indikationen für einen Test entsprechen denen für P. gingivalis und T. denticola:
- Schwere Parodontitis (Stadium III oder IV)
- Unzureichendes Ansprechen auf die mechanische Therapie
- Rasch fortschreitende Erkrankung, besonders bei jüngeren Patienten
- Planung einer systemischen Antibiotikatherapie
- Parodontitis-Rückfall trotz abgeschlossener Behandlung
Da T.f. fast immer gemeinsam mit P. gingivalis auftritt, liefert sein Nachweis im Befund eine wichtige Zusatzinformation: Er bestätigt, dass der rote Komplex vollständig etabliert ist – und damit die Behandlung und Nachsorge entsprechend konsequent sein müssen.
Was muss bei de Behandlung bedacht werden?
Mechanische Therapie
Wie bei allen roten-Komplex-Keimen ist die mechanische Biofilmentfernung die unverzichtbare Grundlage. Da T.f. auf den Biofilm als Nährstoffquelle angewiesen ist, richtet sich die Therapie primär gegen den gesamten roten Komplex. Gründliches Scaling und Root Planing entzieht allen drei Keimen gleichzeitig ihren Lebensraum.
Antibiotika
T.f. ist empfindlich gegenüber Metronidazol. Die Kombination mit Amoxicillin (van Winkelhoff-Protokoll) deckt das gesamte rote-Komplex-Spektrum ab und erfasst gleichzeitig Begleitkeime wie A.a.. Die S3-Leitlinie der EFP (Sanz et al., 2020; ergänzt durch Herrera et al., 2022 für Stadium IV) empfiehlt den Einsatz von Antibiotika nicht routinemäßig, sondern nur bei begründeter Indikation – abhängig vom Schweregrad der Erkrankung und dem Ansprechen auf die mechanische Therapie.
Wichtig: Antibiotika wirken nur dann gegen T.f., wenn der Biofilm zuvor mechanisch aufgebrochen wurde. Ohne vorheriges Scaling können die Wirkstoffe die im Biofilm geschützten Keime nicht erreichen.
Nachsorge
Die enge Verbindung zwischen T.f. und P. gingivalis bedeutet: Wenn P. gingivalis in der Nachsorge wieder ansteigt, folgt T.f. zuverlässig. Regelmäßige Recall-Termine – in den ersten zwei Jahren alle drei Monate – sind bei nachgewiesenem roten Komplex keine Option, sondern Therapiebestandteil.
implantate.com-Fazit:
Tannerella forsythia ist kein Einzeltäter, sondern ein Systembaustein. Sein Nachweis zeigt, dass der rote Komplex vollständig aktiv ist. T.f. macht die Parodontitis hartnäckiger, die Entzündung schwerer kontrollierbar und den Biofilm widerstandsfähiger gegen die Immunabwehr.
Sharma A: Virulence mechanisms of Tannerella forsythia. Periodontology 2000 2010; 54(1):106–116.
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.