Fusobacterium nucleatum (F.n.): organisiert den Parodontitis Biofilm
Ohne Fusobacterium nucleatum würde der Biofilm in der Zahnfleischtasche nie so gefährlich werden, wie er es bei einer Parodontitis ist. F.n. ist kein Zerstörer im eigentlichen Sinne – er ist der Organisator. Er verbindet harmlose Frühbesiedler mit den aggressiven Spätbesiedlern des roten Komplexes und ermöglicht erst, dass P. gingivalis, T. denticola und T. forsythia überhaupt Fuß fassen können. Wer F.n. im Befund hat, hat in der Regel einen Biofilm, der bereits eine kritische Reifestufe erreicht hat.
Und dann ist da noch die Krebsforschung: F.n. ist derzeit eines der meistdiskutierten Bakterien der Medizin – wegen seines nachgewiesenen Zusammenhangs mit Darmkrebs.
Steckbrief Fusobacterium nucleatum
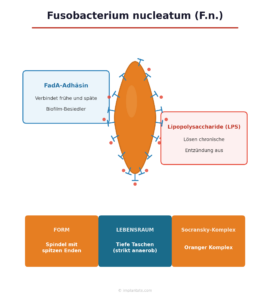
F.n. ist ein gramnegatives, spindelförmiges Stäbchenbakterium mit charakteristisch zugespitzten Enden – daher der Name nucleatum (lat.: kernförmig). Es gehört zum orangen Komplex und ist im gesunden Mund in geringen Mengen normal vorhanden. Erst wenn der orale Biofilm kippt – wenn die Bedingungen anaerob werden und die Zahnfleischtaschen tiefer –, vermehrt sich F.n. in einem Ausmaß, das aktiv zur Krankheit beiträgt.
| Vollständiger Name | Fusobacterium nucleatum |
| Abkürzung | F.n. |
| Form | Spindelförmig mit zugespitzten Enden (fusiform) |
| Sauerstoff | Strikt anaerob – lebt nur ohne Sauerstoff |
| Komplex | Oranger Komplex – zentrale Brückenfunktion |
| Besonderheit | Verbindet frühe und späte Biofilm-Besiedler; nachgewiesener Zusammenhang mit Darmkrebs (kolorektalem Karzinom) |
| Nachweis | Bakterieller Markerkeimtest (PCR) aus Sulkusflüssigkeit |
| Antibiotikum der Wahl | Metronidazol, ggf. in Kombination mit Amoxicillin |
F.n. ist eines der vielseitigsten Bakterien im oralen Biofilm: beweglich, mit einem breiten Repertoire an Oberflächenproteinen ausgestattet und in der Lage, mit einer ungewöhnlich großen Zahl anderer Bakterienarten physischen Kontakt aufzunehmen und stabile Verbindungen einzugehen – sowohl mit Früh- als auch mit Spätbesiedlern.
F.n. als Brückenbauer im Biofilm
Im Biofilm der Zahnfleischtasche gibt es eine klare zeitliche Abfolge: Harmlose Frühbesiedler wie Streptokokken haften zuerst an der Zahnoberfläche. Die wirklich aggressiven Spätbesiedler – P. gingivalis, T. denticola, T. forsythia – können sich dort allein nicht etablieren. Sie brauchen eine Brücke.
F.n. ist diese Brücke. Mit dem Oberflächenprotein FadA und weiteren Adhäsinen bindet er sowohl an Frühbesiedler als auch an Spätbesiedler – und schafft damit die physische Verbindung, die den roten Komplex erst im Biofilm verankert. Studien zeigen, dass ohne F.n. P. gingivalis seine Keimzahl im subgingivalen Biofilm nicht aufbauen kann.
Diese Brückenfunktion macht F.n. zu einem strategischen Ziel: Wer ihn effektiv reduziert, stört nicht nur einen Keim – sondern die gesamte Architektur des pathogenen Biofilms.
So greift F. nucleatum in die Zahnbettzerstörung ein
F.n. ist nicht nur Enabler anderer Keime – er schadet auch direkt.
FadA-Adhäsin. Das Oberflächenprotein FadA bindet an E-Cadherin auf menschlichen Epithelzellen. Dieser Kontakt aktiviert den β-Catenin-Signalweg – einen zentralen Zellkommunikationsweg, der bei Überaktivierung Entzündungen fördert und unkontrolliertes Zellwachstum begünstigt. Genau dieser Mechanismus wird auch in der Darmkrebsforschung intensiv untersucht.
Butyrat. F.n. produziert Butyrat als Stoffwechselprodukt. Im Zahnbett hemmt es die Aktivität von Immunzellen – der Körper kann den Biofilm dadurch weniger effektiv bekämpfen.
Lipopolysaccharide (LPS). Wie alle gramnegativen Bakterien trägt F.n. LPS in seiner Zellwand, das eine chronische Entzündungsreaktion auslöst und unterhält.
Wann wird ein Bakterientest auf F.n. zu empfehlen?
Generell ändern Bakterientests den therapeutischen Ansatz bei leichten und mittelschweren Zahnbettentzündungen kaum. Erst wenn eine Antibiotikatherapie infrage kommt, werden Markerkeimtests interessant. F.n. ist in den meisten Markerkeimtests enthalten. Die Indikationen entsprechen denen der anderen Markerkeime:
- Parodontitis mit unklarem Verlauf oder mangelndem Therapieansprechen
- Fortgeschrittene Parodontitis (Stadium III oder IV)
- Planung einer systemischen Antibiotikatherapie
- Kontrolle nach abgeschlossener Behandlung
Ein hoher F.n.-Nachweis ist zudem ein Hinweis, dass sich der Biofilm bereits zu einem komplexen, reifen Verbund entwickelt hat – und die mechanische Therapie entsprechend konsequent sein muss.
Ws gibt es bei der Behandlung bei F.nucleatum-Nachweis zu bedenken?
Mechanische Therapie
Die konsequente Biofilmentfernung durch Scaling und Root Planing stört die physische Verbundstruktur, die F.n. aufgebaut hat. Da F.n. die Ansiedlung des roten Komplexes ermöglicht, richtet sich die Therapie gegen den gesamten subgingivalen Biofilm – nicht nur gegen einzelne Keime.
Antibiotika
F.n. ist empfindlich gegenüber Metronidazol. Bei gleichzeitigem Nachweis von Keimen des roten Komplexes – was bei F.n.-Befund häufig der Fall ist – empfiehlt sich die Kombination mit Amoxicillin. Die Entscheidung hängt vom Gesamtbefund ab.
Nachsorge
Die Brückenfunktion von F.n. macht konsequente Recall-Termine besonders wichtig: Sobald sich F.n. nach der Behandlung wieder etabliert, können die Keime des roten Komplexes rasch folgen. Regelmäßige professionelle Reinigung unterbricht diesen Wiederaufbau.
|
F.nucleatum und Darmkrebs – was die Forschung weiß
Seit etwa 2012 häufen sich Studien, die F.n. in Tumorgewebe von Darmkrebspatienten nachweisen – in deutlich höherer Konzentration als in gesundem Darmgewebe. F.n. gilt heute als einer der bestdokumentierten mikrobiellen Kofaktoren beim kolorektalen Karzinom.
Die genauen Mechanismen werden noch erforscht. Diskutiert wird, ob F.n. über den FadA/β-Catenin-Weg das Tumorwachstum direkt fördert, ob er die lokale Immunabwehr im Darm schwächt oder ob er als Marker für eine allgemein dysregulierte Mikrobiota steht. Klar ist: F.n. wandert – vermutlich über den Blutweg oder durch Verschlucken – aus der Mundhöhle in den Darm.
Das bedeutet für Patienten mit hohem F.n.-Nachweis nicht automatisch ein erhöhtes Krebsrisiko. Es unterstreicht aber die Bedeutung der Mundgesundheit als Teil der allgemeinen Gesundheit – und gibt der Parodontitis-Behandlung eine systemische Dimension.
F. nucleatum und Periimplantitis
Was F.n. am natürlichen Zahn tut, macht er am Implantat genauso – mit einer wichtigen Besonderheit: Das Implantat hat kein Parodontalligament, keine Sharpey-Fasern, keine Zahnzementschicht. Die biologische Abdichtung gegen Bakterien ist schwächer. Was F.n. einmal als Brücke aufgebaut hat, ist am Implantat deshalb schwerer zu durchbrechen als am natürlichen Zahn.
Aktuelle metagenomische Studien zeigen, dass F.n. in allen Stadien periimplantärer Erkrankungen nachweisbar ist. Dabei treten verschiedene Unterarten (Subspecies) in unterschiedlichen Häufigkeiten auf – welche Subspecies genau mit welchem Erkrankungsstadium assoziiert ist, ist noch Gegenstand aktiver Forschung und wird in der Literatur unterschiedlich bewertet. Sicher ist: F.n. gehört zum sogenannten Peri-Implantitis-Komplex, einer Gruppe von Keimen, die periimplantäre Erkrankungsstellen von gesunden Implantaten am zuverlässigsten unterscheiden.
Die Konsequenz für Implantatträger ist dieselbe wie für Parodontitis-Patienten: Ein F.n.-Nachweis im Markerkeimtest ist kein Zufallsbefund. Er zeigt, dass der Biofilm am Implantat bereits eine kritische Reifestufe erreicht hat – und dass ohne konsequente Reinigung und engmaschige Nachsorge die aggressiven Keime des roten Komplexes folgen werden.
implantate.com-Fazit:
Fusobacterium nucleatum ist der stille Architekt des pathogenen Biofilms. Ohne ihn kommt der rote Komplex nicht in Stellung. Seine Brückenfunktion macht ihn strategisch bedeutsamer als manch aggressiveren Keim – und sein Zusammenhang mit Darmkrebs macht ihn zu einem der medizinisch spannendsten Bakterien der aktuellen Forschung
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.