Markerkeime: welche Bakterien in Ihrem Mund Parodontitis auslösen
In der Mundhöhle leben über 700 verschiedene Bakterienarten. Die allermeisten davon sind harmlos oder sogar nützlich. Unter diesen Hunderten von Arten gibt es jedoch eine Handvoll Spezies, die mit der Zerstörung des Zahnhalteapparats in Verbindung gebracht werden. Diese Arten nennt man Markerkeime (oder Leitkeime): Ihr Nachweis zeigt dem Zahnarzt mit welchen „Leitkeimen“ er es zu tun hat, ob die Parodontosebehandlung allein ausreichen wird oder ob zusätzlich ein Antibiotikum nötig ist – und wenn ja, welches.
Dabei gilt: Kein einzelner Keim macht allein krank. Parodontitis-Bakterien treten in charakteristischen Gruppen auf (Bakterienkomplexe), die sich gegenseitig unterstützen und sogar im Zusammenspiel erst gefährlich werden. Die Forschung hat diese Gruppen in farbcodierte Komplexe eingeteilt, von den harmlosen Erstbesiedlern bis zu den aggressiven Zerstörern des sogenannten roten Komplexes.
Mundflora: meist Freund, mal Feind
Bakterien in unserem Mund: wann wird aus gesund... krank?
Zwischen 20 und 100 Milliarden Bakterien leben zu jedem Zeitpunkt in der Mundhöhle, verteilt auf rund 200 vorherrschende Arten pro Person. Die meisten sind echte Verbündete: Sie halten den pH-Wert im Gleichgewicht, besetzt Oberflächen, die sonst von Krankheitserregern eingenommen würden, und unterstützen sogar die Durchblutung der Mundschleimhaut. Wer sich nach einer Antibiotikatherapie wundert, warum der Mund sich anders anfühlt – das ist die Lücke, die entsteht, wenn diese Schutzflora dezimiert wird.
Von diesen Hunderten von Arten werden weniger als 20 mit der Entstehung einer Parodontitis in Verbindung gebracht. Und selbst diese potenziell krankmachenden Keime – darunter P. gingivalis, der wohl bekannteste – sind bei gesunden Menschen in geringer Zahl nachweisbar, ohne Schaden anzurichten. Nicht ihre Anwesenheit ist das Problem, sondern ihre Überzahl.
Dass sich auf Zahnoberflächen ein dünner Biofilm bildet, ist dabei völlig normal. Innerhalb von Minuten nach dem Zähneputzen beginnen Bakterien, sich auf dem Zahnschmelz anzusiedeln. Dieser junge Biofilm ist nicht krankmachend. Die sogenannten Erstbesiedler – überwiegend gram-positive, sauerstoffverträgliche Arten wie verschiedene Streptokokken – sind für sich genommen weder nützlich noch schädlich. Sie gehören zum normalen Geschehen im Mund.
Zum Problem wird der Biofilm erst, wenn er ungestört reifen kann. Dann verändert sich seine Zusammensetzung. Die Erstbesiedler schaffen durch ihren Stoffwechsel Bedingungen, unter denen sich aggressivere Arten ansiedeln können. Diese sogenannten Brückenkeime – darunter Fusobacterium nucleatum – verbrauchen den verbliebenen Sauerstoff in den tieferen Schichten des Biofilms und schaffen damit eine sauerstofffreie Umgebung. Genau das ist es, was die eigentlichen Parodontitis-Erreger zum Überleben brauchen.
Vereinfacht gesagt: Die Schutzflora hält den Mund gesund. Die Erstbesiedler bilden einen normalen Biofilm. Aber wenn dieser Biofilm nicht regelmäßig entfernt wird, verändern Brückenkeime das Milieu – und die aggressiven Erreger ziehen ein.
Diesen Vorgang – die Verschiebung von einer gesunden, vielfältigen Bakteriengemeinschaft hin zu einer von wenigen aggressiven Arten dominierten Flora – nennt man Dysbiose. Die Parodontitis ist keine Infektion im klassischen Sinne, bei der ein einzelner Erreger eine Krankheit auslöst. Sie ist das Ergebnis einer Gleichgewichtsverschiebung, bei der bestimmte Bakterien überhandnehmen und das Immunsystem zu einer Entzündungsreaktion provozieren, die am Ende mehr Schaden anrichtet als die Bakterien selbst.
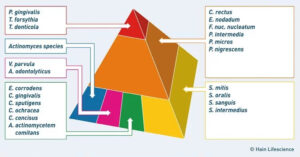
Die Socransky-Komplexe:
Organisiertes Verbrechen am Zahnhalteapparat
Die Erkenntnis, dass parodontale Bakterien nicht einzeln, sondern in charakteristischen Gruppen auftreten, geht auf den kanadischen Mikrobiologen Sigmund Socransky zurück. Er veröffentlichte 1998 eine Studie, die das Verständnis von Parodontitis grundlegend veränderte: Bestimmte Bakterienarten treten immer wieder gemeinsam auf und lassen sich nach ihrer Rolle bei der Krankheitsentwicklung in farbcodierte Komplexe einteilen.
Gelber und grüner Komplex – Die Frühkolonisierer. Hierzu gehören unter anderem verschiedene Streptokokken und Capnocytophaga-Arten. Sie sind die ersten, die sich auf Zahnoberflächen ansiedeln, und haben für sich genommen eine geringe krankmachende Wirkung. Ihre Bedeutung liegt darin, dass sie die Grundlage für die nachfolgenden Komplexe schaffen.
Oranger Komplex – Die Brückenkeime. Dieser Komplex enthält Arten wie Fusobacterium nucleatum, Prevotella intermedia und Campylobacter rectus. Sie sind moderat krankmachend und bilden die entscheidende Brücke zwischen den harmlosen Erstbesiedlern und den hoch aggressiven Erregern des roten Komplexes. Ihre Stoffwechselaktivität entzieht der Umgebung Sauerstoff und schafft so das anaerobe Milieu, das die Erreger des roten Komplexes zum Überleben brauchen. Bei einer konsequenten mechanischen Behandlung – Scaling und Wurzelglättung – lassen sich die Keime des orangen Komplexes in der Regel gut reduzieren.
Roter Komplex – Die Zerstörer. Die drei Bakterienarten dieses Komplexes sind die am stärksten mit fortgeschrittener Parodontitis assoziierten Erreger: Porphyromonas gingivalis, Tannerella forsythia und Treponema denticola. Ihr Nachweis ist fast immer mit tiefen Zahnfleischtaschen, Blutung auf Sondierung und aktivem Gewebeabbau verbunden. Sie produzieren Enzyme, die Kollagenfasern des Zahnhalteapparats aufspalten, und können die schützende Zellschicht des Zahnfleischs durchdringen, um in tiefere Gewebeschichten vorzudringen.
Der Sonderfall A.a. – Aggregatibacter actinomycetemcomitans gehört weder zum roten noch zum orangen Komplex. Er wird einem eigenen Komplex zugeordnet und hat eine besondere klinische Bedeutung: Er ist eng mit besonders aggressiven, oft bei jüngeren Patienten auftretenden Formen der Parodontitis assoziiert. Anders als die Bakterien des roten Komplexes kann er auch in Gegenwart von Sauerstoff überleben, was ihn schwerer zu eliminieren macht. Hinzu kommt: Das gegen andere Parodontitis-Keime wirksame Antibiotikum Metronidazol ist gegen A.a. wirkungslos. Sein Nachweis erfordert daher eine angepasste antibiotische Strategie, typischerweise mit Amoxicillin.
Die fünf Leitkeime: Hauptverdächtige im Steckbrief
Porphyromonas gingivalis (P.g.) – Der Mastermind
P. gingivalis ist der wohl am besten erforschte Parodontitis-Keim. Er überlebt nur unter sauerstofffreien Bedingungen und besiedelt bevorzugt tiefe Zahnfleischtaschen. Seine Besonderheit: Er kann die schützende Zellschicht des Zahnfleischs durchdringen und sich im darunterliegenden Gewebe einnisten – für eine rein mechanische Reinigung schwer erreichbar. Er produziert Enzyme (Gingipaine), die das Immunsystem gleichzeitig stimulieren und unterlaufen, und profitiert von der Entzündung, die er selbst provoziert: Je stärker sie ist, desto besser seine Lebensbedingungen.
In den letzten Jahren untersucht die Forschung seine mögliche Rolle bei Alzheimer, Herz-Kreislauf-Erkrankungen und rheumatoider Arthritis. Mehr zu Parodontitis und Allgemeingesundheit.
Tannerella forsythia (T.f.)
Tritt fast immer gemeinsam mit P. gingivalis auf und verstärkt dessen Wirkung. Ebenfalls strikt anaerob und auf tiefe Taschen angewiesen. Produziert Enzyme, die Bindegewebe abbauen und die Immunantwort modulieren. Allein weniger aggressiv, aber als Teil des roten Komplexes ein wichtiger Faktor bei der Krankheitsprogression.
Treponema denticola (T.d.)
Ein spiralförmiges Bakterium, das sich aktiv durch das Gewebe schrauben kann und deshalb tief in Zahnfleischtaschen eindringt. Arbeitet eng mit P. gingivalis zusammen – die beiden verstärken sich gegenseitig in ihrer krankmachenden Wirkung.
Aggregatibacter actinomycetemcomitans (A.a.)
Die Sonderstellung unter den Parodontitis-Keimen: Überlebt auch unter Sauerstoff, tötet mit einem Leukotoxin gezielt weiße Blutkörperchen ab und ist resistent gegen das Standard-Antibiotikum Metronidazol. Klinisch besonders relevant bei Patienten unter 35 mit rasch fortschreitender Parodontitis. Sein Nachweis ist einer der wenigen Fälle, in denen ein Bakterientest eine klare therapeutische Weichenstellung liefert.
Prevotella intermedia (P.i.)
Gehört zum orangen Komplex – eher Brückenkeim als Hauptzerstörer. Besonderheit: Reagiert auf Steroidhormone (Östrogen, Progesteron), weshalb er sich in der Schwangerschaft vermehrt und – zusammen mit der hormonell bedingten stärkeren Durchblutung des Zahnfleischs – die typische Schwangerschaftsgingivitis begünstigt. Lässt sich in der Regel durch konsequente mechanische Behandlung gut kontrollieren.
Der Bakterientest: Was er kann und was nicht
Ein Bakterientest (auch: Markerkeimdiagnostik, mikrobiologische Diagnostik) identifiziert per DNA-Analyse, welche Parodontitis-assoziierten Keime in Ihren Zahnfleischtaschen vorhanden sind und in welcher Konzentration. Das Verfahren ist unkompliziert und schmerzfrei: Der Zahnarzt führt feine Papierspitzen in die Taschen ein, die Sulkusflüssigkeit aufsaugen. Die Proben gehen ins Labor, das Ergebnis liegt nach wenigen Tagen vor.
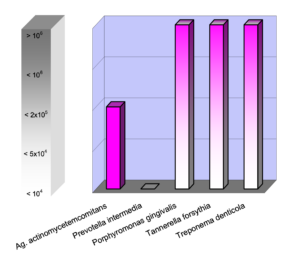
Was der Test liefert: Ein bakterielles Profil Ihrer Zahnfleischtaschen. Er zeigt, ob und welche Markerkeime vorhanden sind, und gibt deren Konzentration an. Daraus ergibt sich, ob eine begleitende Antibiotikatherapie sinnvoll wäre – und wenn ja, welches Antibiotikum zum nachgewiesenen Erregerspektrum passt. Das ist besonders relevant bei Aggregatibacter actinomycetemcomitans (A.a.): Gegen diesen Keim ist das sonst übliche Metronidazol wirkungslos, sodass ein Nachweis die Wahl des Antibiotikums direkt verändert.
Was der Test nicht liefert: Eine Diagnose. Er ersetzt nicht die klinische Befunderhebung – Taschentiefen, Blutung, Knochenabbau im Röntgenbild. Und er sagt nichts darüber aus, ob Ihr Immunsystem mit den nachgewiesenen Keimen zurechtkommt oder nicht. Ein Befund mit hohen Konzentrationen von P. gingivalis kann bei dem einen Patienten mit einer schweren Parodontitis einhergehen, bei einem anderen mit stabilen Verhältnissen.
Wann verändert das Ergebnis die Behandlung?
Die mechanische Therapie – das Reinigen der Wurzeloberflächen – ist die Grundlage jeder Parodontitisbehandlung, unabhängig vom Testergebnis. Eine begleitende Antibiotikatherapie kommt nach aktueller S3-Leitlinie vor allem in Frage bei generalisierten Formen der Parodontitis im Stadium III oder IV bei jüngeren Erwachsenen, also bei Patienten mit schwerer, rasch fortschreitender Erkrankung. In diesen Fällen liefert der Bakterientest eine konkrete therapeutische Weichenstellung: Er zeigt, ob A.a. vorhanden ist und welches Antibiotikum-Schema angezeigt wäre.
Bei leichteren und moderaten Verläufen, die gut auf die mechanische Therapie ansprechen, wird das Testergebnis die Behandlung in der Regel nicht verändern. Die Therapie bleibt dieselbe.
Die Kosten: 80 bis 150 Euro, je nach Umfang. Die gesetzliche Krankenversicherung übernimmt die Kosten nicht. Private Versicherer erstatten die Diagnostik in der Regel.
Aus Behandlersicht hat der Test keinen medizinischen Nachteil – er ist schmerzfrei, nicht invasiv und liefert im schlechtesten Fall eine Information, die das weitere Vorgehen bestätigt. Gerade bei schweren Verläufen kann ein Bakterienbefund auch der Dokumentation dienen und die Therapieentscheidung absichern. Ob Ihr Zahnarzt ihn empfiehlt, hängt vom klinischen Bild ab – fragen Sie gezielt nach, wenn Sie wissen möchten, welche Keime in Ihren Taschen nachweisbar sind.
Dysbiose: Warum Markerkeime alleine nicht reichen
Das Komplexmodell nach Socransky hat das Verständnis von Parodontitis über zwei Jahrzehnte geprägt und ist als klinisches Ordnungssystem nach wie vor nützlich. Aber die Forschung der letzten Jahre hat das Bild differenziert.
Ursprünglich ging man davon aus, dass bestimmte Bakterien – ähnlich wie bei der Tuberkulose ein einzelner Erreger – kausal die Parodontitis verursachen. Man suchte den einen Schuldigen. Heute weiß man: So einfach ist es nicht. P. gingivalis und die anderen Markerkeime sind bei praktisch jedem Menschen in der Mundhöhle nachweisbar – in geringer Zahl. Ihr bloßes Vorhandensein macht nicht krank. Erst wenn das Gleichgewicht der gesamten Bakteriengemeinschaft kippt, wenn die Vielfalt abnimmt und wenige aggressive Arten die Oberhand gewinnen, entsteht eine Parodontitis.
Moderne Analyseverfahren wie das Next Generation Sequencing erlauben heute einen viel tieferen Blick in die Zusammensetzung des Biofilms als die klassische Markerkeimdiagnostik. Was dabei sichtbar wird: Parodontitis-Patienten haben nicht einfach „mehr schlechte Bakterien“, sondern ein grundlegend anderes Ökosystem in der Zahnfleischtasche. Die Artenvielfalt verändert sich, die Gleichmäßigkeit der Verteilung nimmt ab, einzelne Spezies dominieren. Gesunde Patienten zeigen dagegen hochindividuelle, vielfältige Mikrobiomsignaturen.
Für den Patienten bedeutet das: Es geht nicht darum, einzelne Bakterien zu eliminieren. Es geht darum, die Bedingungen wiederherzustellen, unter denen ein gesundes Gleichgewicht bestehen kann. Genau das ist der Ansatz der modernen Parodontitistherapie: Die mechanische Reinigung entfernt den Biofilm. Die Nachsorge verhindert, dass er sich in krankmachender Zusammensetzung neu bildet. Und die Risikofaktorenkontrolle – Rauchstopp, Diabeteseinstellung, Stressreduktion – sorgt dafür, dass das Immunsystem angemessen reagieren kann.
Ansteckungsgefahr: Kann ich meinen Partner mit Parodontose infizieren?
Eine der häufigsten Fragen, die Patienten stellen – und eine, die eine differenzierte Antwort verdient.
Ja, Parodontitis-Bakterien sind übertragbar. Studien zeigen, dass Partner, die im selben Haushalt leben, häufig ähnliche Bakterienstämme in der Mundhöhle tragen. Die Übertragung findet über Speichel statt – also durch Küssen, gemeinsam genutztes Besteck oder Zahnbürsten.
Aber: Die Übertragung von Bakterien bedeutet nicht die Übertragung der Erkrankung. Ob sich aus der Besiedlung mit Parodontitis-Keimen tatsächlich eine Parodontitis entwickelt, hängt von vielen weiteren Faktoren ab – der eigenen Immunantwort, der Mundhygiene, genetischen Faktoren, Rauchen, Diabetes, Stress. Viele Menschen tragen Parodontitis-Markerkeime in sich, ohne jemals zu erkranken.
Die praktische Konsequenz: Wenn bei Ihnen eine Parodontitis diagnostiziert wird, sollte Ihr Partner sich beim nächsten Zahnarztbesuch ebenfalls untersuchen lassen – nicht aus Panik, sondern aus Vorsorge. Getrennte Zahnbürsten sind ohnehin selbstverständlich, gemeinsam genutztes Besteck ist kein realistischer Übertragungsweg in relevantem Ausmaß. Wichtiger als die Angst vor Ansteckung ist die eigene Prophylaxe: Wer eine gute Mundhygiene betreibt und regelmäßig zur Kontrolle geht, hat auch bei Kontakt mit Parodontitis-Keimen ein geringes Erkrankungsrisiko.
implanatte.com-Fazit:
Nicht einzelne Bakterien verursachen die Parodontitis, sondern das Kippen des gesamten Ökosystems. Die mechanische Therapie – das Reinigen der Wurzeloberflächen – bleibt die tragende Säule der Behandlung: Sie entfernt den Biofilm und gibt der Mundflora die Chance, ins Gleichgewicht zurückzufinden. Antibiotika können diese Therapie in bestimmten Fällen ergänzen, aber nie ersetzen. Und die beste Vorsorge ist das, was Sie selbst täglich tun: Mundhygiene, Nachsorge, Risikofaktoren im Griff behalten.
Dewhirst FE, Chen T, Izard J et al.: The Human Oral Microbiome. J Bacteriol 2010; 192(19):5002–5017.
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.