Antibiotikatherapie der Parodontitis und Periimplantitis
Bei schwerer Parodontitis können Antibiotika den Unterschied machen. Sie erreichen Bakterien im Gewebe, die der Zahnarzt mit Instrumenten nicht entfernen kann – Keime, die tief in das Gewebe eingedrungen sind und die Entzündung von dort aus am Laufen halten. Mit der richtigen Indikation eingesetzt, können schwere Parodontitis-Fälle deutlich erfolgreicher behandelt werden.
Die entscheidende Frage ist: Wann ist der richtige Moment – und warum braucht es mehr als nur Tabletten?
Antibiose in der Parodontologie auf einen Blick
| Frage | Antwort |
|---|---|
| Sind systemische Antibiotika bei Parodontitis immer notwendig? | Nein – sie sind nur bei bestimmten schweren Verläufen als adjuvante Maßnahme sinnvoll. |
| Welche Patienten profitieren am meisten? | Jüngere Patienten (unter 56 Jahren) mit einem hohen Anteil tiefer Taschen (mehr als 35 % der Stellen ≥ 5 mm). |
| Empfohlenes Standardregime | Amoxicillin 500 mg plus Metronidazol 400 mg, jeweils 3× täglich für 7 Tage. |
| Therapie bei Penicillin-Allergie | Metronidazol als Monotherapie; alternative Schemata nach individueller Risikoabschätzung und Erregerlage. Siehe Tabelle weiter unten. |
| Werden Antibiotika von der Kasse übernommen? | Ja, die Medikamente selbst in der Regel schon – der mikrobiologische Keimtest ist jedoch eine Selbstzahlerleistung (typischerweise im zweistelligen bis niedrigen dreistelligen Euro-Bereich). |
| Optimaler Zeitpunkt für den Beginn | Unmittelbar nach der subgingivalen Instrumentierung (Scaling/Root Planing) – nicht vor der mechanischen Therapie (Biofilm-Problematik) |
Das Problem: Antibiotika und Biofilm
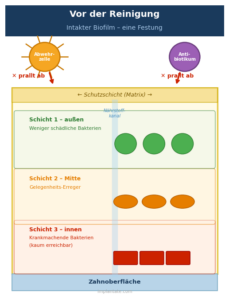
Parodontitis ist keine gewöhnliche bakterielle Infektion. Die krankmachenden Keime leben nicht frei im Gewebe, sondern in einem organisierten Gemeinschaftsverbund: dem Biofilm. In dieser Struktur umhüllen sich die Bakterien gegenseitig mit Schutzschichten aus Proteinen und Zuckermolekülen. Das Ergebnis: Antibiotika kommen schlecht durch. Bakterien, die im Labor noch auf ein Mittel ansprechen würden, können im intakten Biofilm um ein Vielfaches toleranter gegenüber denselben Wirkstoffen sein.
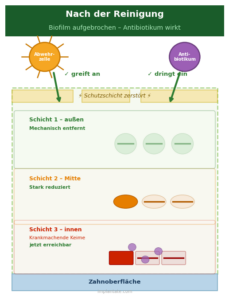
Das hat eine wichtige praktische Konsequenz: Wer Antibiotika bei Parodontitis einsetzt, ohne den Biofilm vorher mechanisch zu zerstören, erreicht wenig. Die Leitlinien sind deshalb eindeutig – die mechanische Reinigung, das sogenannte Scaling und Root Planing, geht immer zuerst. Antibiotika beginnen unmittelbar danach.
Die roten Komplex-Bakterien – Porphyromonas gingivalis, Treponema denticola und Tannerella forsythia – können zudem Epithelzellen invadieren und sich so der mechanischen Reinigung teilweise entziehen. Das ist einer der Gründe, warum eine adjuvante Antibiose bei schweren Formen sinnvoll sein kann: Sie erreicht das Gewebe, das der Zahnarzt mit dem Instrument nicht direkt berüh
|
Wann sind Antibiotika sinnvoll bei Parodontose?
Die aktuelle S3-Leitlinie der Deutschen Gesellschaft für Parodontologie (DG PARO), die seit 2021 für Deutschland gilt und auf der europäischen EFP-Leitlinie von 2020 basiert, ist bei diesem Punkt ungewöhnlich klar: Antibiotika sollen nicht routinemäßig bei der Parodontitistherapie eingesetzt werden.
Das klingt strenger als es früher war – und das ist Absicht. Antibiotikaresistenzen nehmen weltweit zu, und auch die Zahnmedizin trägt dazu bei. Jede Verordnung ohne klare Indikation ist eine Verordnung zu viel.
Konkret empfiehlt die Leitlinie eine adjuvante Antibiose nur unter bestimmten Bedingungen. Die folgende Übersicht fasst die wichtigsten Kriterien zusammen. Entscheiden muss der Zahnarzt.
| ✔ Adjuvante Antibiose erwägenswert | ✘ Antibiotika nicht indiziert |
|---|---|
| ✔Patienten unter 56 Jahren | ✘Patienten ab 56 Jahren |
| ✔Stadium III (schwer) | ✘Stadium I oder II (mild bis moderat) |
| ✔Mehr als 35 % der Messstellen mit Taschentiefe ≥ 5 mm | ✘Wenige tiefe Taschen, gutes Ansprechen auf Reinigung |
| ✔A. actinomycetemcomitans im Abstrich nachgewiesen | ✘Keine aggressiven Markerkeime nachweisbar |
| ✔Rascher Attachmentverlust (Grad C), Patient ≤ 35 Jahre | ✘Langsame Progression, stabile Befunde |
Die stärksten Belege gibt es für Patienten unter 56 Jahren mit schwerer Parodontitis bei mehr als 35 Prozent tiefer Stellen. Bei A. actinomycetemcomitans–Nachweis gilt die Antibiose als gesondert indiziert – unabhängig vom Alter. Ob A.a. vorliegt, zeigt ein mikrobiologischer Abstrich. Die Leitlinie schreibt diesen Test nicht vor – die GKV erstattet ihn nicht – er verbessert aber die Zielgenauigkeit der Therapie erheblich.
Was ist erste das Antibiotikum der 1. Wahl bei Parodontitis?
Wenn eine Antibiose indiziert ist, gibt es klare Empfehlungen. Wichtig vorab: Die DG PARO-Leitlinie ist primär als empirische Empfehlung formuliert – also ohne zwingenden Bakterientest vorab. Das bedeutet: Amoxicillin + Metronidazol bleibt erste Wahl bei allen Markerkeimen:
Porphyromonas gingivalis (P.g.)
Tannerella forsythia (T.f.)
Treponema denticola (T.d.)
auch wenn kein A.a. nachgewiesen wurde. Der Grund: Die Kombination hat in klinischen Studien konsistent bessere Ergebnisse gezeigt als Metronidazol allein, und das Keimspektrum ist bei schwerer Parodontitis in der Praxis oft nur unvollständig bekannt.
Die folgende Tabelle zeigt alle gängigen Optionen mit korrekter Einstufung nach Erst- und Zweitwahl:
| Indikation | Wirkstoff | Dosierung | Dauer | Besonderheit | Leitlinie |
|---|---|---|---|---|---|
| ① Empirisch / kein A.a. – Standardfall (auch ohne Bakterientest) | |||||
| Empirisch oder A.a.-negativ | 1. Wahl Amoxicillin + Metronidazol |
500 mg · 3× tägl. 400 mg · 3× tägl. |
7 Tage | Erste Wahl auch ohne A.a.-Nachweis. Kombination zeigt in klinischen Studien bessere Ergebnisse als Metronidazol allein – gilt unabhängig vom Keimtest. | DE EFP AAP |
| Amoxicillin nicht verfügbar oder nicht verträglich | 2. Wahl Metronidazol (allein) |
400 mg · 3× tägl. | 7 Tage | Ausdrücklich zweite Wahl laut DG PARO – nur bei Nicht-Verfügbarkeit oder Unverträglichkeit von Amoxicillin. Kein Standardschema. | DE EFP |
| ② A. actinomycetemcomitans nachgewiesen – Kombinationstherapie zwingend | |||||
| A.a.-positiver Befund | Amoxicillin + Metronidazol |
500 mg · 3× tägl. 400 mg · 3× tägl. |
7 Tage | Van-Winkelhoff-Schema. A.a. zeigt regelmäßig sehr hohe Metronidazol-MIC-Werte; Amoxicillin verbessert die Wirkstoffaufnahme synergistisch. Metronidazol-Monotherapie nicht zuverlässig. | DE EFP AAP |
| Ciprofloxacin + Metronidazol |
250 mg · 2× tägl. 500 mg · 2× tägl. |
7 Tage | Alternative bei Amoxicillin-Unverträglichkeit. Fluorochinolone (Cipro, Moxifloxacin) zeigen konsistent gute Wirksamkeit gegen A.a.-Stämme. | AAP | |
| ③ Penicillin-Allergie – Alternativen bei Amoxicillin-Unverträglichkeit | |||||
| Penicillin- / Amoxicillin-Allergie | Metronidazol (allein) |
400 mg · 3× tägl. | 7 Tage | Erste Wahl bei Penicillin-Allergie laut DG PARO – sofern kein A.a. nachgewiesen. In dieser Konstellation korrekte Ersttherapie. | DE EFP |
| Doxycyclin | 100 mg · 1–2× tägl. | 7 Tage | Option bei A.a.-Nachweis und Penicillin-Allergie. Photosensibilisierung beachten. Nicht bei Kindern < 8 Jahren. | DE AAP | |
| Azithromycin | 500 mg · 1× tägl. | 3 Tage | Kurzes Schema, gute Gewebegängigkeit. ⚠ In Deutschland für Zahn-/Mundbereich nicht zugelassen (Off-Label). | EFP AAP | |
| ④ Reserveantibiotika – nur in begründeten Ausnahmefällen | |||||
| Therapieversagen, Resistenznachweis | Moxifloxacin | 400 mg · 1× tägl. | 7 Tage | Fluorchinolon Gr. 4. In vitro sehr konsistente Wirksamkeit gegen alle parodontalpathogenen Keime inkl. A.a. Nur Reservemittel – nicht für Routinetherapie. | DE |
| Amoxicillin/ Clavulansäure |
500/125 mg · 3× tägl. | 7 Tage | Bei Therapieversagen auf Amoxicillin. Breiteres Spektrum durch Betalactamaseschutz. | AAP | |
| ⑤ Historisch gebräuchlich – für Parodontitis-Therapie nicht leitlinienkonform | |||||
| Penicillin-Allergie (historisch DE) | Clindamycin | 300 mg · 4× tägl. | 7 Tage | Fehlt in allen aktuellen Parodontitis-Leitlinien (DG PARO, EFP, AAP). In DE weiterhin überdurchschnittlich verschrieben – ohne internationale Evidenzbasis für Parodontitis-Therapie. Natürliche Resistenz von A.a. gegen Clindamycin. Black-Box-Warnung: C.-difficile-Kolitis. Hinweis: AHA 2021 strich Clindamycin aus der Endokarditis-Prophylaxe – das betrifft eine Einmalgabe präoperativ, nicht die Parodontitis-Therapie. |
⚠ DE (Sonderrolle) |
|
Periimplantitis: grösseres Problem, kaum mit Antibiotika beizukommen
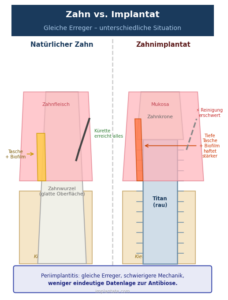
Was bei natürlichen Zähnen gilt, gilt am Implantat in verschärfter Form. Die Bakterien, die eine Periimplantitis verursachen, überlappen stark mit den Parodontitis-Erregern: roter Komplex, Fusobacterium nucleatum, Prevotella intermedia – bekannte Gesichter in neuem Kontext.
Das Problem: Die raue Titanoberfläche eines Implantats bietet Bakterien sogar noch mehr Anhaftungsmöglichkeiten als eine Zahnwurzel. Biofilme haften dort hartnäckiger. Gleichzeitig ist die mechanische Reinigung schwieriger – klassische Küretten, die für Zahnwurzeln entwickelt wurden, können die Implantatoberfläche beschädigen.
Bei chirurgischer Periimplantitis-Therapie wird eine begleitende Antibiose diskutiert und in Einzelfällen eingesetzt. Die Datenlage ist hier weniger eindeutig als bei der Parodontitis-Therapie. Belastbare Leitlinienempfehlungen mit klaren Grenzwerten fehlen bislang. Auch hier gilt: mechanische Reinigung zuerst.
Der entscheidende Unterschied zur Prophylaxe: Das Kapitel zur Antibiotikaprophylaxe vor Implantationen behandelt die präoperative Einmalgabe zur Infektionsprävention – eine andere Situation als die therapeutische Antibiose bei bereits bestehender Entzündung.
Nebenwirkungen – Nutzen: Risiko abwägen
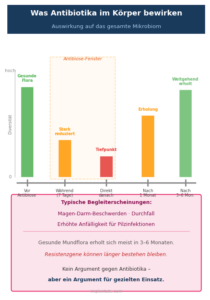
Antibiotika wirken nicht selektiv. Wer Amoxicillin und Metronidazol nimmt, verändert vorübergehend das gesamte Mikrobiom des Körpers. Magen-Darm-Beschwerden, Durchfall und eine erhöhte Anfälligkeit für Pilzinfektionen sind häufige Begleiterscheinungen. Die Einnahme mit einer Mahlzeit verbessert die Verträglichkeit deutlich.
Der tiefere Punkt ist ein anderer: Jede Antibiotikaeinnahme hinterlässt Spuren im Resistenzgeschehen. Untersuchungen aus Deutschland an rund 8.000 Parodontitispatienten zeigen, dass parodontalpathogene Bakterien in etwa zwei Dritteln der Fälle bereits gegen mindestens ein getestetes Antibiotikum resistent sind. Amoxicillin und Metronidazol halten sich noch gut – aber die Situation ist nicht statisch.
Das ist kein Argument gegen den gezielten Einsatz. Es ist ein Argument gegen den unkritischen Einsatz. Ein Parodontologe, der keine Antibiotika verschreibt, handelt nicht nachlässig – er folgt der Leitlinie.
Kosten: Wer bezahlt die Antibiotika bei Parodontitis?
Die Antibiotika selbst – Amoxicillin und Metronidazol – sind bei entsprechender Indikation im Rahmen der Kassenbehandlung verordnungsfähig. Die Kosten trägt die gesetzliche Krankenkasse.
Anders verhält es sich mit dem mikrobiologischen Test. Dieser ist keine Kassenleistung – er wird als individuelle Gesundheitsleistung (IGeL) privat abgerechnet und kostet je nach Labor zwischen 80 und 150 Euro. Mehr dazu im Kapitel Mikrobiologischer Test bei Parodontitis sowie in der Kostenübersicht zur Parodontitisbehandlung.
implantate.com-Fazit
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.
Deutsche Gesellschaft für Parodontologie (DG PARO): Die Behandlung von Parodontitis Stadium I bis III – Deutsche Implementierung der S3-Leitlinie der EFP. DG PARO/DGZMK, 02/2021.
Tätigkeitsschwerpunkt Implantologie, Spezialist für Parodontologie und Zahnersatz,
Mitgliedschaften(u.a.), Deutsche Gesellschaft f. Zahn-, Mund- und Kieferheilkunde (DGZMK), Deutsche Gesellschaft f. Implantologie (DGI), Deutsche Gesellschaft f. Paodontologie (DGParo)