Aggregatibacter actinomycetemcomitans (A.a.): Leitkeim der Parodontitis
Antibiotikawahl durch A.a. verändert
Aggregatibacter actinomycetemcomitans kommt bei rund einem Viertel aller gesunden Erwachsenen in der Mundhöhle vor. Sein bloßes Vorhandensein ist noch kein Grund zur Beunruhigung. Entscheidend ist – wie bei allen Markerkeimen – die Kombination aus Keimmenge, klinischem Befund (Taschentiefen, Blutung, Knochenabbau) und dem Ansprechen auf die bisherige Behandlung. A.a. lässt sich durch mechanische Reinigung (Parodontosebehandlung) allein oft nicht dauerhaft unter die Nachweisgrenze drücken. Er dringt in das Zahnfleischgewebe ein und bildet dort hartnäckige Biofilme, die weder Zahnbürste noch Kürette vollständig erreichen.
Was A.a. von den anderen Markerkeimen unterscheidet: Er ist der einzige klinisch relevante Parodontitis-Keim, dessen Nachweis die Antibiotikawahl direkt beeinflusst. Während bei den strikt anaeroben Keimen des roten Komplexes – allen voran P. gingivalis – Metronidazol allein ausreicht, braucht es bei A.a. zwingend die Kombination mit Amoxicillin – die sogenannte Van-Winkelhoff-Kombination. Der Grund: A.a. ist ein fakultativer Anaerobier. Er überlebt auch in Gegenwart von Sauerstoff und ist deshalb gegenüber Metronidazol allein häufig unempfindlich.
Steckbrief Aggregatibacter actinomycetemcomitans
| Eigenschaft | Details |
|---|---|
| Abkürzung | A.a. |
| Komplex | Keinem der klassischen Socransky-Komplexe zugeordnet – bildet eine eigene Kategorie (sog. A.a.-Komplex) |
| Sauerstoffbedarf | Fakultativ anaerob – überlebt mit und ohne Sauerstoff. Bevorzugt 5–10 % CO₂ (kapnophil) |
| Lebensraum | Zahnfleischtaschen, Zahnoberflächen, Mundschleimhaut. Kann auch flachere Taschen besiedeln als die strikt anaeroben Keime des roten Komplexes |
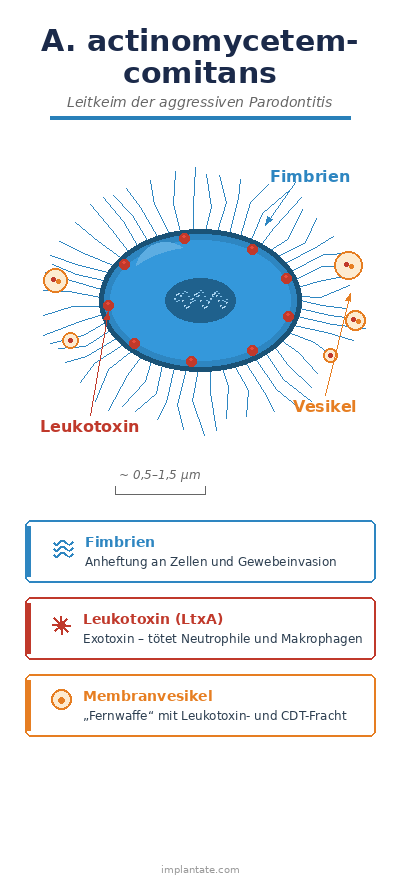
| Hauptwaffen | Leukotoxin (LtxA) – tötet weiße Blutkörperchen; Cytolethal Distending Toxin (CDT) – stoppt die Zellteilung von Immunzellen |
| Besonderheit | Einziges Mundhöhlenbakterium, das zwei Eiweissgifte (Exotoxine) gleichzeitig produziert |
| Klinische Bedeutung | Klassischer Leitkeim der früheren „aggressiven Parodontitis“ (heute: Parodontitis Grad C, Molar-Inzisiv-Muster). Sein Nachweis verändert die Antibiotikawahl |
| Wirksame Antibiotika | Amoxicillin + Metronidazol (Van-Winkelhoff-Kombination), Doxycyclin, Azithromycin. Metronidazol allein häufig nicht ausreichend |
| Nachweisbar über | Markerkeimtest (DNA-Analyse aus Zahnfleischtaschenflüssigkeit) |
| Früherer Name | Actinobacillus actinomycetemcomitans (bis 2006) |
So greift A.a. den Zahnhalteapparat an
A.a. arbeitet mit einer anderen Strategie als P. gingivalis. Während P. gingivalis vor allem das Immunsystem so manipuliert, dass die körpereigene Abwehr den Zahnhalteapparat zerstört, schaltet A.a. die Abwehr gezielt aus – und zwar mit zwei Waffen, die kein anderes Bakterium der Mundhöhle besitzt:
Leukotoxin (LtxA) ist die Hauptwaffe. Dieses Toxin tötet weiße Blutkörperchen – insbesondere Neutrophile, Monozyten und Makrophagen, also genau die Zellen, die der Körper zur Bekämpfung bakterieller Infektionen einsetzt. Das Ergebnis: Die erste Verteidigungslinie des Immunsystems wird am Ort der Infektion geschwächt. A.a. kann sich ungestört vermehren.
Nicht alle A.a.-Stämme sind gleich gefährlich. Der sogenannte JP2-Klon produziert 10- bis 20-mal mehr Leukotoxin als andere Stämme. Träger dieses Klons haben ein deutlich erhöhtes Risiko für einen raschen Knochenabbau, besonders im Jugendalter. Der JP2-Klon ist in Nordwestafrika verbreitet und in Deutschland selten, aber nicht ausgeschlossen.
Cytolethal Distending Toxin (CDT) ist die zweite Waffe. Dieses Toxin greift direkt in die Zellteilung ein: Es schädigt die DNA von Immunzellen und stoppt deren Vermehrung. Zusätzlich stimuliert CDT die Bildung von RANKL – einem Botenstoff, der Osteoklasten aktiviert und damit den Knochenabbau vorantreibt.
Zusammen ergibt sich ein doppelter Angriff: Leukotoxin beseitigt die Abwehrzellen, CDT verhindert deren Nachschub und treibt gleichzeitig den Knochenabbau voran. Dieser Mechanismus erklärt, warum A.a.-assoziierte Parodontitis häufig schneller fortschreitet als Formen, die vorwiegend durch den roten Komplex verursacht werden.
Eine weitere Besonderheit: A.a. kann – wie P. gingivalis – die schützende Zellschicht des Zahnfleischs durchdringen und sich im darunterliegenden Gewebe einnisten. Dort bildet er hartnäckige Biofilme. Das ist der Hauptgrund dafür, dass die mechanische Reinigung der Wurzeloberflächen (Scaling und Root Planing) allein bei A.a. oft nicht ausreicht, um den Keim dauerhaft unter die Nachweisgrenze zu drücken.
A.a. bedroht auch unseren gesamten Körper
A.a. gehört zur sogenannten HACEK-Gruppe – einer Gruppe von Mundhöhlenbakterien, die eine Gemeinsamkeit haben: Sie können die Blutbahn erreichen und Herzklappen infizieren. HACEK steht für Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella und Kingella – alles Keime, die normalerweise harmlos in Mund und Rachen leben, aber bei Eintritt in die Blutbahn schwere Infektionen verursachen können.
Endokarditis: A.a. ist der häufigste Verursacher einer infektiösen Endokarditis innerhalb der HACEK-Gruppe. Insgesamt sind HACEK-Keime für 1–3 % aller Fälle von infektiöser Endokarditis verantwortlich – eine seltene, aber potenziell lebensbedrohliche Komplikation. Charakteristisch: Der Verlauf ist schleichend, die Diagnose wird im Durchschnitt erst nach etwa drei Monaten gestellt. In Fallserien hatten knapp die Hälfte der Betroffenen eine vorbestehende Parodontitis oder kurz zuvor eine Zahnbehandlung, über 60 % hatten eine vorgeschädigte Herzklappe oder eine Klappenprothese.
Weitere systemische Infektionen: In der Literatur finden sich Berichte über Hirnabszesse, Pneumonien, Weichteilabszesse und Gelenkinfektionen durch A.a. – allesamt selten, aber dokumentiert. A.a. wurde darüber hinaus in atherosklerotischen Plaques und in Plazenten von Frauen mit Präeklampsie nachgewiesen.
Für Patienten bedeutet das: A.a. ist kein reines Zahnproblem. Besonders bei Patienten mit Herzklappenvorschädigungen oder Klappenprothesen ist die konsequente Behandlung und Nachsorge einer A.a.-assoziierten Parodontitis auch aus internistischer Sicht relevant.
Ausführlich im Kapitel Parodontitis und Allgemeingesundheit
Ist eine Infektion mit A.a. ansteckend?
A.a. wird meist innerhalb der Familie übertragen, vor allem von Eltern auf Kinder, etwa über Speichelkontakt (z. B. gemeinsames Besteck, Schnuller in den Mund nehmen, Küsse). Auch eine Übertragung zwischen Partnern ist möglich. Diese vertikale Übertragung ist gut dokumentiert. Horizontale Übertragung (zwischen Partnern oder Geschwistern) ist seltener, aber möglich. Übertragungswege sind gemeinsam genutzte Zahnbürsten, Essbesteck und direkter Speichelkontakt. Die Übertragung des Keims bedeutet nicht automatisch, dass der Empfänger erkrankt – ob sich A.a. dauerhaft ansiedelt und Schaden anrichtet, hängt von der individuellen Immunlage und der Mundflora ab.
Behandlung bei A.a.-Nachweis
Hier liegt der klinisch wichtigste Unterschied zu den anderen Markerkeimen: A.a. ist ein fakultativer Anaerobier (kann mit und ohne Sauerstoff überleben). Metronidazol – das Standardantibiotikum gegen die strikt anaeroben Keime des roten Komplexes – wirkt gegen A.a. allein häufig nicht ausreichend. Der Grund ist biochemisch: Metronidazol muss im Inneren der Bakterienzelle aktiviert werden, und das geschieht nur unter strikt anaeroben Bedingungen. A.a. kann Sauerstoff tolerieren und entzieht sich damit teilweise diesem Wirkmechanismus.
Die Lösung: Amoxicillin wird hinzugefügt. Die Kombination aus Metronidazol und Amoxicillin – nach ihrem Erstbeschreiber als Van-Winkelhoff-Kombination bekannt – ist bei A.a. die Therapie der Wahl. Der Synergismus ist gut untersucht: Amoxicillin schädigt die Bakterienzellwand und erleichtert dadurch die Aufnahme von Metronidazol in die Zelle. In der Pionierstudie von van Winkelhoff (1992) war A.a. nach mechanischer Therapie plus Antibiotika bei 96,6 % der Patienten nicht mehr nachweisbar.
Die Therapie folgt im Grundsatz der Standardbehandlung der Parodontitis: Scaling und Root Planing bleiben die tragende Säule. Die begleitende Antibiotikatherapie erfolgt zusätzlich, nicht anstelle der mechanischen Behandlung.
Was muss man bei der Behandlung von A. actinomycetemcomitans beachten?
Die aktuelle S3-Leitlinie empfiehlt systemische Antibiotika nicht routinemäßig, sondern bei generalisierten Formen, die auf die mechanische Behandlung allein nicht ausreichend ansprechen. Gerade bei A.a. war jedoch der Nachweis des Keims historisch ein Hauptgrund für die Antibiotikagabe – weil die mechanische Therapie allein A.a. häufig nicht unter die Nachweisgrenze drücken konnte. Die Deutsche Gesellschaft für Parodontologie (DG PARO) empfahl bis 2018 bei A.a.-Nachweis explizit eine begleitende Antibiotikatherapie.
| Antibiotikum | Einsatz | Anmerkung |
|---|---|---|
| Metronidazol + Amoxicillin | Mittel der Wahl bei A.a.-Nachweis | Van-Winkelhoff-Kombination. Synergismus: Amoxicillin erleichtert die Metronidazol-Aufnahme |
| Doxycyclin | Alternative | In-vitro teilweise wirksamer als Amoxicillin/Metronidazol gegen A.a.-Biofilme |
| Azithromycin | Alternative bei Unverträglichkeit | Weniger Studienlage als Van-Winkelhoff-Kombination |
| Metronidazol allein | Nicht empfohlen bei A.a. | A.a. ist fakultativ anaerob → variable Empfindlichkeit gegenüber Metronidazol |
Der Nachweis von A.a. macht – wie bei P. gingivalis – die konsequente Nachsorge (UPT) unverzichtbar. Weil A.a. im Gewebe überleben kann und durch mechanische Reinigung allein schwer zu eliminieren ist, ist das Rückfallrisiko bei vernachlässigter Nachsorge besonders hoch. Was das für den Alltag bedeutet, beschreibt das Kapitel Behandlung der Parodontitis im Abschnitt zur Nachsorge.
implantate.com-Fazit
A.a. ist der Markerkeim, der die Therapie verändert: Sein Nachweis macht die Kombination aus Metronidazol und Amoxicillin notwendig, weil Metronidazol allein gegen diesen fakultativen Anaerobier häufig nicht ausreicht. A.a. schaltet mit seinem Leukotoxin die körpereigene Immunabwehr gezielt aus und lässt sich durch mechanische Reinigung allein oft nicht dauerhaft eliminieren. Gerade bei A.a. gilt: Ohne begleitende Antibiotikatherapie und ohne konsequente Nachsorge ist ein dauerhafter Behandlungserfolg schwer zu erreichen.
Dewhirst FE, Chen T, Izard J et al.: The Human Oral Microbiome. J Bacteriol 2010; 192(19):5002–5017.
Behandlungsrichtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen (PAR-Richtlinie). In Kraft seit 01.07.2021.