Biofilme im Mund
Orale Bakterien in (un)heiliger Allianz
Bakteriengemeinschaften in einer schützen Matrix (z.B. Plaque) werden in der Zahnmedizin als Biofilm bezeichnet. Bakterien schließen sich zu hochorganisierten Gemeinschaften zusammen und umgeben sich mit einer schützenden Schleimschicht. In dieser Form sind sie deutlich widerstandsfähiger und schädlicher als einzelne Keime.
Der orale Biofilm ist die zentrale Ursache für nahezu alle Erkrankungen im Mund. Karies entsteht durch Säuren, die Bakterien im Biofilm produzieren. Zahnfleischentzündungen und Parodontitis werden durch Biofilm ausgelöst, der sich am Zahnfleischrand und in den Zahnfleischtaschen festsetzt. Auch bei Implantaten kann Biofilm zu schwerwiegenden Entzündungen führen.
Gleichzeitig ist Biofilm etwas völlig Natürliches. Er bildet sich ständig neu, bei jedem Menschen, auch bei perfekter Mundhygiene. Das Ziel kann deshalb nicht sein, ihn vollständig zu verhindern – sondern ihn durch regelmäßige Entfernung im Gleichgewicht zu halten.
Was ist ein Biofilm und wie entsteht er?
Biofilme entstehen überall dort, wo Feuchtigkeit auf Oberflächen trifft – in Wasserleitungen, auf Kathetern, auf Kontaktlinsen. Im menschlichen Körper sind sie allgegenwärtig: Im Darm schützt ein bakterieller Biofilm die Schleimhaut und ist für die Verdauung unverzichtbar. Im Mund hingegen kann er zur Gesundheitsgefahr werden, wenn das bakterielle Gleichgewicht kippt.
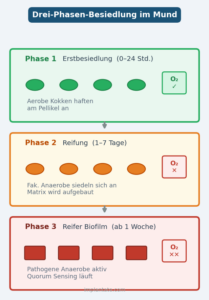
Der Aufbau eines oralen Biofilms läuft in drei Phasen ab, die direkt ineinandergreifen:
Phase 1 – Erstbesiedlung (0–24 Stunden): Direkt nach der Zahnreinigung lagern sich Speichelproteine auf der Zahnoberfläche ab und bilden das sogenannte Pellikel. An diese Schicht heften sich als erste aerobe Kokken, vor allem Streptokokken. Sie brauchen Sauerstoff zum Leben und sind noch relativ harmlos. Dieser frühe Biofilm lässt sich durch Zähneputzen problemlos entfernen.
Phase 2 – Reifung (1–7 Tage): Die Erstbesiedler verbrauchen Sauerstoff und schaffen damit sauerstoffarme Nischen. Die Bakterien produzieren eine klebrige Matrix aus Polysacchariden, Eiweißen und extrazellulärer DNA – durch sie entstehen interne Nährstoffkanäle. Der Biofilm ist jetzt kein einfacher Belag mehr, sondern ein strukturiertes Netzwerk. Fakultativ anaerobe Bakterien siedeln sich an.
Phase 3 – Reifer Biofilm (ab 1 Woche): In der sauerstofffreien Tiefe etablieren sich obligat anaerobe Bakterien, die bei Sauerstoffkontakt absterben würden. Darunter die Hauptverursacher der Parodontitis: Porphyromonas gingivalis, Tannerella forsythia und Treponema denticola – der sogenannte Rote Komplex nach Socransky. Bleibt der Biofilm länger bestehen, lagern sich Mineralien ein: Der weiche Belag verhärtet zu Zahnstein, der sich nicht mehr durch Zähneputzen entfernen lässt.
Bakterielle Kommunikation im Biofilm
Lange dachte man, Bakterien im Biofilm würden einfach nebeneinander existieren. Heute wissen wir: Sie kommunizieren intensiv miteinander über kleine Signalmoleküle. Dieser Prozess heißt Quorum Sensing.
Sobald genügend Bakterien vorhanden sind und eine bestimmte Konzentration an Botenstoffen erreicht ist, ändern die Mikroorganismen ihr Verhalten grundlegend. Sie beginnen koordiniert, ihre Angriffsfähigkeit zu erhöhen, entwickeln Toleranz gegen die Immunabwehr und werden widerstandsfähiger gegen antimikrobielle Substanzen wie Antibiotika oder Mundspülungen.
Diese bakterielle Kommunikation ermöglicht es dem Biofilm, auf Veränderungen in seiner Umgebung zu reagieren. Die Bakterien organisieren ihre Stoffwechselprozesse, teilen sich die Aufgaben und schützen sich gegenseitig. Das macht den gereiften Biofilm zu einem hocheffizienten System – und zu einem schwierigen Gegner in der Therapie.
Warum ist einem Biofilm so schwer beizukommen?
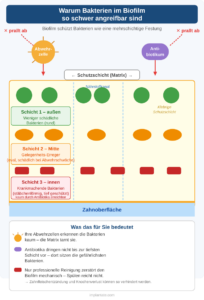
Die extrazelluläre Matrix ist das Kernproblem: Sie wirkt wie ein physischer Schutzschild. Abwehrzellen des Immunsystems haben Schwierigkeiten einzudringen. Mundspülungen erreichen nur die äußeren Schichten. Antibiotika, die gegen frei schwimmende (planktonische) Bakterien wirken, scheitern am organisierten Biofilm – die Resistenz steigt im Verbund um ein Vielfaches.
Hinzu kommt das Quorum Sensing: Bakterien kommunizieren über Signalmoleküle und stimmen ihr Verhalten ab. Sobald eine kritische Dichte erreicht ist, ändert die gesamte Gemeinschaft schlagartig ihr Verhalten – sie produzieren mehr Matrix, aktivieren Virulenzfaktoren und werden toleranter gegen Immunabwehr und Antibiotika. Die Gemeinschaft agiert dann wie ein Organismus.
[Grafik: Biofilm als Festung – Immunzelle und Antibiotikum prallen ab]
[Grafik: Quorum Sensing]
Deshalb gilt bei schweren Parodontitisfällen die Grundregel: Erst den Biofilm mechanisch zerstören, dann – falls nötig – Antibiotika. Ohne die vorherige mechanische Behandlung bleiben die Bakterien im Biofilm vor der Wirkung der Medikamente geschützt. → Mehr dazu im Kapitel Parodontitis behandeln.
Auf welche Biofilme im Mund müssen wir achten?
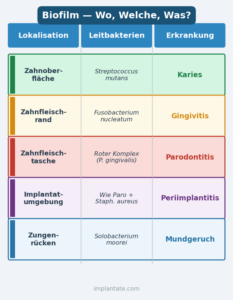
Biofilm bildet sich bevorzugt dort, wo die Selbstreinigung durch Speichel, Zunge und Kaubewegungen nicht ausreicht: in den Zahnzwischenräumen, am Zahnfleischrand, in Zahnfleischtaschen und auf dem Zungenrücken. Die Zusammensetzung – und damit die Gefährlichkeit – unterscheidet sich je nach Lokalisation erheblich.
| Lokalisation | Leitbakterien | Erkrankung |
|---|---|---|
| Zahnoberfläche | Streptococcus mutans | Karies |
| Zahnfleischrand | Fusobacterium nucleatum | Gingivitis |
| Zahnfleischtasche (subgingival) | Roter Komplex (P. gingivalis, T. forsythia, T. denticola) | Parodontitis |
| Implantatumgebung | Wie Paro + Staphylokokken/Opportunisten | Periimplantitis |
| Zungenrücken | Solobacterium moorei u. a. | Mundgeruch (Halitosis) |
[Grafik: Biofilm – Wo, Welche, Was?]
Der kariesaktive Biofilm
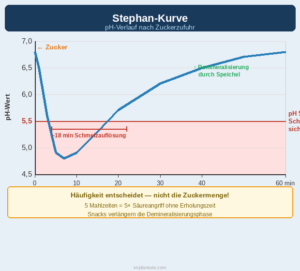
Karies entsteht nicht durch Bakterien an sich, sondern durch eine spezifische metabolische Leistung bestimmter Bakterien im supragingivalen Biofilm: die Umwandlung von Zucker in organische Säuren, die den Zahnschmelz auflösen.
Der Hauptverantwortliche ist Streptococcus mutans – ein Bakterium, das in der frühen Biofilmbesiedlung noch keine dominante Rolle spielt, aber unter zuckerhaltigen Bedingungen rasch die Oberhand gewinnt. S. mutans besitzt zwei entscheidende Eigenschaften: Es überlebt extrem niedrige pH-Werte, bei denen andere Bakterien absterben, und es produziert aus Saccharose wasserunlösliche Glukane, mit denen es sich fest an die Zahnoberfläche und an seine Nachbarn heftet. Diese Glukane verdichten die Biofilmmatrix und erschweren die Diffusion von Speichel, der normalerweise die Säuren puffert und den Schmelz remineralisiert.
Das Geschehen läuft in einem dynamischen Gleichgewicht ab: Direkt nach dem Essen fällt der pH-Wert unter der Plaque auf Werte um 5 oder tiefer – deutlich unterhalb der kritischen Schwelle von pH 5,5, bei der Hydroxylapatit aus dem Zahnschmelz herausgelöst wird. Hält die Säureexposition zu lange an oder kommt es zu häufig, kann die Remineralisierung durch Speichel und Fluorid nicht mehr mithalten. Der Schmelz verliert Mineralien, die Oberfläche wird porös, und es entsteht eine Läsion.
Neben S. mutans spielen Lactobacillus-Spezies eine bedeutende Rolle – allerdings eher in der Progression als in der Entstehung: Sie gedeihen bevorzugt in bereits vorhandenen kariösen Läsionen, wo sie durch ihren extremen Säuretoleranz das Fortschreiten des Schadens vertiefen. Weitere Karies-assoziierte Keime wie Streptococcus sobrinus und Scardovia wiggsiae sind in der Forschung zunehmend im Fokus, aber in ihrer klinischen Bedeutung noch nicht abschließend bewertet.
Was die Lage kompliziert: Kariogene Bakterien wie S. mutans sind bei nahezu jedem Menschen im Mund vorhanden – auch bei Menschen ohne Karies. Entscheidend ist nicht die bloße Anwesenheit des Keims, sondern das Ernährungsmuster, das ihm den nötigen Selektionsvorteil verschafft. Häufige Zuckerzufuhr – besonders in Form vieler kleiner Mahlzeiten oder zuckerhaltiger Getränke, die immer wieder kleine Säureschübe auslösen – verschiebt das ökologische Gleichgewicht im Biofilm zugunsten von S. mutans und seinen Verbündeten. Seltener Zuckerkonsum, ausreichend Speichelfluss und Fluorid halten den kariogenen Biofilm hingegen in Schach.
Biofilm erzeugt Gingivitis
Eine Zahnfleischentzündung (Gingivitis) ist die häufigste Erkrankung im Mund und gleichzeitig die am einfachsten reversible: Sie ist die direkte Antwort des Immunsystems auf einen gereiften supragingivalen Biofilm am Zahnfleischrand – und sie verschwindet vollständig, sobald dieser Biofilm konsequent entfernt wird.
Das Leitbakterium in diesem Prozess ist Fusobacterium nucleatum – ein gramnegativer Anaerobier, der im Biofilm eine Schlüsselrolle als Brückenorganismus einnimmt. F. nucleatum hält sich von Beginn an im Zahnfleischrandbereich auf und vermittelt als vielseitiger Koaggregationspartner die Verbindung zwischen frühen aeroben Erstbesiedlern (Streptokokken) und späten obligat anaeroben Keimen des Roten Komplexes. Es ist damit keine Ursache der Gingivitis im engeren Sinne, aber ein zentraler Treiber der Biofilmreifung – derjenige Keim, der den Übergang von harmloser Plaque zu pathogenem Entzündungsstimulus organisiert.
Das Immunsystem reagiert auf den Biofilm am Sulkus – dem Spalt zwischen Zahn und Zahnfleisch – mit einer kontrollierten Entzündungsantwort: Die Gefäße weiten sich, Immunzellen wandern ins Gewebe ein, das Zahnfleisch wird rot und geschwollen. Klinisch erkennbar ist die Gingivitis vor allem durch Bluten beim Zähneputzen oder bei der Sondierung. Der Knochen ist zu diesem Zeitpunkt noch nicht betroffen – das ist der entscheidende Unterschied zur Parodontitis.
Bleibt der Biofilm über Wochen und Monate bestehen, reift er weiter. F. nucleatum schafft durch seinen Sauerstoffverbrauch und seine Koaggregationsleistung die Voraussetzungen dafür, dass die obligat anaeroben Parodontitiserreger des Roten Komplexes in der Tiefe des Sulkus Fuß fassen können. Gingivitis ist damit nicht nur eine eigenständige Erkrankung, sondern – wenn unbehandelt – der Eintrittspfad zur Parodontitis.
Wichtig für Patienten: Blutungen beim Zähneputzen sind kein Zeichen, dass man zu fest bürstet oder mit dem Zähneputzen aufhören sollte. Sie sind ein Signal des Immunsystems, dass eine Entzündung vorliegt. Wer die Blutung vermeiden möchte, muss den Biofilm entfernen – nicht das Putzen reduzieren.
|
Der Biofilm bei Parodontitis
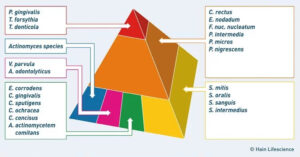
Was am Zahnfleischrand als Gingivitis beginnt, kann sich in sauerstoffarmen Zahnfleischtaschen zu einer grundlegend anderen Erkrankung entwickeln: Bei der Parodontitis bestimmen nicht mehr die frühen aeroben Besiedler das Geschehen, sondern ein hochspezifisches Konsortium obligat anaerober Bakterien – der Rote Komplex nach Socransky, bestehend aus Porphyromonas gingivalis, Tannerella forsythia und Treponema denticola, sie gehören alle zu den Markerkeimen.
Diese drei Keime sind aufeinander angewiesen und agieren synergistisch: P. gingivalis ist der Schlüsselvirulenzträger. Seine Gingipaine – Proteasen, die Bindegewebe und Kollagen spalten – schaffen aus Protein die Aminosäuren, von denen sich T. forsythia ernährt. T. denticola hingegen liefert über seine Spirochätenstruktur eine besondere Beweglichkeit, die es ermöglicht, tief in das Taschensystem einzudringen. Das Trio stimmt sein Verhalten über Quorum Sensing ab und bildet einen Biofilm, der gegen Immunabwehr und Antibiotika außerordentlich resistent ist.
Was die Parodontitis von einer gewöhnlichen Infektion unterscheidet, ist der Mechanismus des Gewebeschadens: Nicht die Bakterien selbst lösen direkt Knochen auf – das tut das überschießende Immunsystem. Das Immunsystem erkennt die Lipopolysaccharide gramnegativer Keime und reagiert mit der Ausschüttung proinflammatorischer Mediatoren wie Interleukin-1β, TNF-α und Matrix-Metalloproteinasen. Diese Mediatoren zerstören Kollagenfasern des Zahnhalteapparats und aktivieren Osteoklasten zum Knochenabbau. Der Entzündungsreflex, der eigentlich Schutz bieten soll, richtet den eigentlichen Schaden an.
Deshalb erkranken nicht alle Menschen mit identen Keimen im Mund an Parodontitis – die individuelle Immunreaktion ist entscheidend. Genetische Faktoren, Rauchen, schlecht eingestellter Diabetes und Stress können die Immunantwort in eine destruktive Richtung verschieben. Der aktuelle Forschungsstand versteht Parodontitis nicht mehr als reine Infektionskrankheit, sondern als Folge einer Dysbiose: Das Gleichgewicht im subgingivalen Biofilm kippt, die Immunregulation verliert die Kontrolle.
Die therapeutische Konsequenz ist klar: Ohne mechanische Zerstörung des subgingivalen Biofilms durch Scaling und Root Planing bleibt jede weitere Maßnahme – ob Spülung, Mundwasser oder Antibiotikum – weitgehend wirkungslos. Erst wenn die Biofilmstruktur aufgebrochen ist, werden Antibiotika überhaupt wirksam.
Biofilm sorgt für eine Periimplantitis
Das Grundprinzip der Periimplantitis ist identisch mit dem der Parodontitis: Ein gereifter Biofilm mit dominierenden Anaerobiern des Roten Komplexes löst eine Immunreaktion aus, die Knochen abbaut. Die Keime sind weitgehend dieselben – P. gingivalis, T. forsythia, T. denticola und F. nucleatum – ergänzt um opportunistische Spezies wie Staphylococcus epidermidis und Enterobacteriaceae, die an natürlichen Zähnen seltener auftreten.
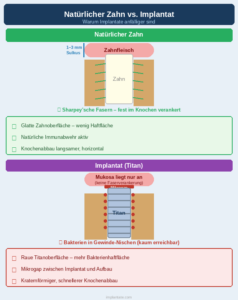
Was das Implantat gegenüber dem natürlichen Zahn anfälliger macht, sind mehrere strukturelle Besonderheiten. Das periimplantäre Gewebe – Mukosa und Knochen – ist anders aufgebaut als der natürliche Zahnhalteapparat: Während an natürlichen Zähnen Sharpey’sche Fasern das Bindegewebe fest mit dem Zement verbinden, liegt die Mukosa dem Implantat nur an. Die Schutzbarriere ist damit mechanisch schwächer. Hinzu kommt die Oberfläche: Die mikroraue Struktur des Implantattitans ist für die Osseointegration gewollt, bietet Bakterien aber erheblich mehr Anhaftungsfläche als polierter Schmelz. Im Mikrogap zwischen Implantat und Abutment sammeln sich Bakterien in einem Bereich, der für Reinigungs- und Behandlungsinstrumente praktisch nicht erreichbar ist.
Der Krankheitsverlauf ist dadurch aggressiver als bei Parodontitis: Der Knochenabbau schreitet kraternförmig voran, nicht graduell horizontal wie am natürlichen Zahn, und kann in kurzer Zeit substanziellen Knochenverlust verursachen. Eine Früherkennung – regelmäßige Sondierung und Röntgenkontrolle – ist deshalb bei Implantatpatienten besonders wichtig.
Der entscheidende Unterschied zur Parodontitisbehandlung liegt in der mechanischen Zugänglichkeit: An natürlichen Zähnen kann die Wurzeloberfläche mit Handinstrumenten und Ultraschall verhältnismäßig effizient debridiert werden. Am Implantat sind die Gewindestrukturen schwerer zu reinigen, und konventionelle Stahlküretten können die Titanoberfläche beschädigen. Laser, Glycinpulver-Wasserstrahl-Systeme und Titanküretten sind etablierte Alternativen – aber alle stoßen an Grenzen, wenn der Knochen kraternförmig verloren ist.
Biofilm auf der Zunge: Mundgeruch
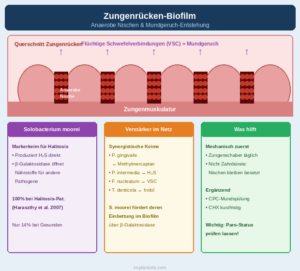
Mundgeruch ist in über 85 % aller Fälle ein rein orales Problem – und im Zentrum steht fast immer der Biofilm auf dem Zungenrücken. Die papilläre Struktur der Zungenoberfläche schafft ein komplexes Nischenreservoir für anaerobe Bakterien: Zwischen den Papillen herrscht Sauerstoffarmut, dort sammeln sich abgestorbene Epithelzellen, Speichelproteine und Nahrungsreste, die als Substrat dienen.
Der Markerkeim schlechthin ist Solobacterium moorei – ein obligat anaerobes, grampositives Stäbchen, das 2008 von Haraszthy et al. in einer klinischen Studie bei 100 % der Probanden mit pathologischer Halitosis auf dem Zungenrücken nachgewiesen wurde, aber nur bei 14 % ohne Mundgeruch. S. moorei produziert Schwefelwasserstoff (H₂S) und ist über seine Beta-Galaktosidase-Aktivität in der Lage, andere geruchserzeugende Bakterien im Biofilm zu fördern: Es erschließt Nährstoffe für proteolytische Keime wie P. gingivalis und P. intermedia, die dann vermehrt flüchtige Schwefelverbindungen (VSCs) produzieren. S. moorei wirkt damit als Verstärker im Biofilm-Netzwerk, nicht nur als Einzeltäter.
Die Chemie des Mundgeruchs ist konkret: Anaerobe Bakterien bauen schwefelhaltige Aminosäuren wie Cystein und Methionin ab und erzeugen dabei flüchtige Schwefelverbindungen – Schwefelwasserstoff (rieht nach faulen Eiern), Methylmercaptan (Fäule, Kohl) und Dimethylsulfid. Dazu kommen Polyamine wie Putrescin und Cadaverin, die aus dem Abbau von Arginin und Lysin entstehen. Diese Verbindungen sind in geringsten Konzentrationen olfaktorisch wahrnehmbar – eine Eigenschaft, die ihre diagnostische Relevanz unterstreicht: Organolepische Messung und Sulfid-Monitor erlauben eine objektive Graduierung.
Mundgeruch durch Zungenbelag ist häufig auch ein Hinweis auf eine Ko-Erkrankung: Parodontitis-Taschen sind ein weiteres Reservoir für VSC-produzierende Anaerobier, und umgekehrt. Wer an chronischem Mundgeruch leidet und keine Besserung durch Zungenreinigung und optimierte Mundhygiene erzielt, sollte den Zahnfleischstatus überprüfen lassen.
Therapeutisch ist die mechanische Entfernung des Zungenbelags – mit einem Zungenschaber, nicht mit der Zahnbürste – der effektivste erste Schritt. Mundspülungen mit Cetylpyridiniumchlorid oder Chlorhexidin können ergänzend wirken, weil sie den oberflächlichen Anteil des Zungenbelag-Biofilms beeinflussen. Anders als in Zahnfleischtaschen ist die Zugänglichkeit auf dem Zungenrücken für antiseptische Mittel deutlich besser.
Neue Erkenntnisse aus der Biofilm-Forschung
Die Biofilmforschung der letzten Jahre hat unser Verständnis oraler Erkrankungen grundlegend verändert.
Bakterien, die ihre Rolle wechseln Das Helmholtz-Zentrum für Infektionsforschung entdeckte, dass das normalerweise harmlose Bakterium Prevotella nigrescens seine Rolle ändert, sobald eine Entzündung vorliegt. Es verwandelt sich dann in ein aggressives Pathogen. Diese Erkenntnis zeigt: Nicht nur die Anwesenheit bestimmter Bakterien ist entscheidend, sondern auch der Zustand des umgebenden Gewebes.
Ebenso wurde bei Fusobacterium nucleatum eine lange gehegte Annahme revidiert: Dieses Bakterium galt als relativ harmlos, solange keine Entzündung vorliegt. Neuere Genanalysen zeigen, dass F. nucleatum unabhängig vom Entzündungsstatus aktiv ist – und seine eigentliche Gefährlichkeit liegt woanders: Es ist das verbindende Glied im Biofilm, das harmlose Frühbesiedler mit den aggressiven Parodontitiserregern der Tiefenschicht zusammenbringt. Ohne F. nucleatum würde der Rote Komplex im subgingivalen Biofilm deutlich schwerer Fuß fassen.
Vom Infektions- zum Dysbiose-Konzept Der wichtigste Paradigmenwechsel betrifft das grundsätzliche Verständnis biofilminduzierter Erkrankungen. Lange galten sie primär als Infektionskrankheiten, die durch bestimmte Bakterien verursacht werden. Heute sehen Forscher sie eher als Folge einer Dysbiose – eines gestörten Gleichgewichts im Biofilm – die eine Fehlsteuerung der Immunantwort auslöst.
Diese Sichtweise erklärt, warum nicht jeder Mensch mit den gleichen Bakterien im Mund auch erkrankt: Entscheidend ist die individuelle Reaktion des Immunsystems auf die Dysbiose.
Neue Therapieansätze Die veränderte Sichtweise führt zu neuen Behandlungsstrategien. Statt die Bakterien komplett zu eliminieren – was ohnehin nicht möglich ist – versuchen moderne Ansätze, das Gleichgewicht im Biofilm wiederherzustellen.
Ein Beispiel ist die Entwicklung des Fraunhofer-Instituts: Der Wirkstoff blockiert gezielt das Wachstum von Porphyromonas gingivalis, einem Haupterreger der Parodontitis, lässt aber die harmlosen Bakterien der Mundflora intakt. Anders als herkömmliche Antibiotika oder Chlorhexidin-Spülungen, die alle Bakterien abtöten, bleibt hier das mikrobielle Gleichgewicht erhalten. Der Wirkstoff ist inzwischen in einer Zahnpasta und einem professionellen Pflegegel verfügbar.
Auch an Mikronadelpflastern wird geforscht, die Wirkstoffe direkt ins entzündete Gewebe bringen und dabei sowohl antibakteriell wirken als auch die Immunantwort modulieren.
Die Guided Biofilm Therapy (GBT) setzt auf eine systematische, schrittweise Biofilmentfernung mit schonenden Pulver-Wasser-Gemischen statt der traditionellen Handinstrumente. Das Ziel ist maximale Effektivität bei minimaler Schädigung der Zahnsubstanz.
Was kann ich als Patient tun? Das Biofilm-Management
Da sich Biofilm ständig neu bildet, geht es nicht darum, ihn ein für alle Mal zu beseitigen. Ziel ist vielmehr ein konsequentes Biofilm-Management – regelmäßige Entfernung, bevor er sich zu einem dicken, pathogenen Belag entwickelt.
Häusliche Mundhygiene: Durch zweimal tägliches Zähneputzen lässt sich frischer, weicher Biofilm gut entfernen. Entscheidend ist die Regelmäßigkeit: Je früher der Biofilm gestört wird, desto weniger Zeit haben die Bakterien, eine robuste Matrix aufzubauen und sich zu organisieren.
Die Zahnbürste erreicht allerdings nur etwa 70 Prozent der Zahnoberflächen. Die Zahnzwischenräume – dort, wo Karies und Parodontitis bei Erwachsenen meist beginnen – lassen sich nur mit Zahnseide oder Interdentalbürsten reinigen. Diese tägliche Interdentalreinigung ist deshalb kein optionales Extra, sondern unverzichtbarer Bestandteil der Mundhygiene.
Mundspülungen können die mechanische Reinigung unterstützen, aber nicht ersetzen. Sie erreichen den Biofilm an der Zahnoberfläche nur oberflächlich und haben keine Wirkung gegen ausgereiften Biofilm in den Zahnfleischtaschen.
Professionelle Zahnreinigung: Selbst bei gründlicher häuslicher Mundhygiene bleiben Bereiche, die nicht ausreichend gereinigt werden können. Zudem verhärtet sich Biofilm mit der Zeit zu Zahnstein, der nur noch professionell entfernt werden kann.
Die professionelle Zahnreinigung (PZR) in der Zahnarztpraxis beseitigt harte und weiche Beläge auch an schwer zugänglichen Stellen. Mit Ultraschall, Handinstrumenten und Pulver-Wasser-Gemischen werden die Zähne gründlich gereinigt, anschließend poliert und häufig mit Fluoridlack versiegelt.
Wie oft eine PZR notwendig ist, hängt vom individuellen Risiko ab. Bei gesunden Zähnen und Zahnfleisch genügen oft ein bis zwei Termine pro Jahr. Bei erhöhtem Kariesrisiko, nach einer Parodontitisbehandlung oder bei Implantaten sind kürzere Intervalle – alle drei bis vier Monate – sinnvoll.
Ernährung: Häufiger Zuckerkonsum gibt den säureproduzierenden Bakterien im Biofilm ständig Nahrung. Entscheidend ist dabei weniger die Menge als die Häufigkeit: Viele kleine zuckerhaltige Zwischenmahlzeiten sind ungünstiger als eine größere Menge Zucker auf einmal, da der Zahnschmelz zwischen den Säureattacken Zeit zur Remineralisierung braucht.
Der Speichel spielt bei der Biofilmkontrolle eine zentrale Rolle. Er spült lose anhaftende Bakterien weg, puffert Säuren ab und liefert Mineralien für die Reparatur des Zahnschmelzes. Alles, was den Speichelfluss anregt – Kaugummikauen, ballaststoffreiche Kost – unterstützt die natürliche Biofilmkontrolle. Mundtrockenheit hingegen erhöht das Risiko für Karies und Zahnfleischentzündungen deutlich.
implantate.com-Fazit:
Bakterieller Biofilm im Mund ist kein Zufall – er folgt einem System. Welche Erkrankung entsteht, hängt davon ab, welche Keime die Oberhand gewinnen und wie das Immunsystem reagiert. Wer das versteht, begreift auch, warum mechanische Reinigung – Zähneputzen, Zahnseide, Zungenschaber – keine Kosmetik ist, sondern die einzige wirksame Strategie, das mikrobielle Gleichgewicht im Mund dauerhaft zu erhalten. Regelmäßige Kontrolltermine beim Zahnarzt ergänzen das, was zu Hause nicht erreichbar ist.
Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL. Microbial complexes in subgingival plaque. J Clin Periodontol. 1998;25(2):134–44. https://pubmed.ncbi.nlm.nih.gov/9495612/
Bradshaw DJ, Marsh PD, Watson GK, Allison C. Role of Fusobacterium nucleatum and coaggregation in anaerobe survival in planktonic and biofilm oral microbial communities during aeration. Infect Immun. 1998;66(10):4729–32. https://pubmed.ncbi.nlm.nih.gov/9746571/
Szafráński SP, Deng ZL, Tomasch J et al. Functional biomarkers for chronic periodontitis and insights into the roles of Prevotella nigrescens and Fusobacterium nucleatum; a metatranscriptome analysis. npj Biofilms Microbiomes. 2015;1:15017. https://pubmed.ncbi.nlm.nih.gov/28721234/
Hajishengallis G, Darveau RP, Curtis MA. The keystone-pathogen hypothesis. Nat Rev Microbiol. 2012;10(10):717–25. https://pubmed.ncbi.nlm.nih.gov/22941505/
Rakic M, Galindo-Moreno P, Monje A et al. How frequent does peri-implantitis occur? A systematic review and meta-analysis. Clin Oral Implants Res. 2018;29 Suppl 16:33–49. https://pubmed.ncbi.nlm.nih.gov/30328190/
Lafaurie GI, Sabogal MA, Castillo DM et al. Microbiome and microbial biofilm profiles of peri-implantitis: a systematic review. J Periodontol. 2017;88(10):1066–1089. https://pubmed.ncbi.nlm.nih.gov/28625077/
Sousa V, Nibali L, Spratt D, Dopico J et al. Peri-implant and periodontal microbiome diversity in aggressive periodontitis patients. Clin Oral Implants Res. 2017;28(5):558–567. https://pubmed.ncbi.nlm.nih.gov/26826133/
Haraszthy VI, Zambon JJ, Sreenivasan PK et al. Identification of oral bacterial species associated with halitosis. J Am Dent Assoc. 2007;138(8):1113–20. https://pubmed.ncbi.nlm.nih.gov/17670880/
Haraszthy VI, Gerber D, Clark B et al. Characterization and prevalence of Solobacterium moorei associated with oral halitosis. J Breath Res. 2008;2(1):017002. https://pubmed.ncbi.nlm.nih.gov/21386146/